糖尿病と新型コロナウイルス感染症(COVID-19)
| 山岸 昌一 | 昭和大学医学部内科学講座糖尿病・代謝・内分泌内科学部門 教授 |
| COI: | なし |
- 糖尿病があるとCOVID-19感染症が重症化しやすいことが示されている。
- 糖尿病とCOVID-19感染症の重症化との間には、双方向性の関連性が推定される。つまり、糖尿病の存在そのものが、COVID-19感染症の重症化に寄与し、また、COVID-19感染症により、インスリン抵抗性が誘導され、糖尿病の悪化を促す可能性がある。
- COVID-19感染糖尿病患者の管理と治療に関しては、COVID-19感染症の程度が軽症かあるいは無症状で、食事が摂れる患者に対しては、従来通りの糖尿病治療を継続して行う。
- 在宅療養中の患者に対しては、インスリン注射をはじめとする従来の糖尿病治療を中断しないように説明し、可能であれば血糖値をチェックするように指示し、電話相談など遠隔医療の環境を整備する。食事が十分に摂取できない場合は、sick dayのルールに従い、薬剤を減量・中止する。
- さらに、COVID-19感染の重症例では、血糖値が高値となり、異化の亢進や脱水などにより、ケトアシドーシスや高浸透圧高血糖症候群による昏睡のリスクも高まることから、感染管理と補液に加え、インスリンを用いた血糖管理を積極的に行う。
- 血糖コントロールの程度が、糖尿病合併COVID-19感染患者の予後を予測する一指標になると考えられている。
糖尿病と易感染性
糖尿病では、1型、2型のタイプを問わず、感染症に罹りやすくなり、感染症死のリスクが高まることが報告されている[1,2]。また、インフルエンザが重症化しやすいことも知られており、ワクチン接種が推奨されている[2]。
糖尿病患者では、自然免疫、獲得免疫ともに障害される。実際、高血糖あるいは糖尿病状態では、ウイルス感染細胞の食細胞による貪食能力やナチュラルキラー細胞による殺菌活性が低下するだけでなく、抗原抗体複合体への補体の結合能も落ち、易感染性がひきおこされる [3] 。
糖尿病とCOVID-19感染症の疫学
COVID-19感染者における糖尿病の合併率は、対象患者の年齢、調査された地域、ならびに患者の重症度により大きく異なる。中国での報告では、糖尿病の合併率は〜15%とされ、集中治療室や人工呼吸器機での治療を必要としたり、死の転帰をとった患者では約35%とされている [4] 。
また、米国の疾病対策予防センターCDCでまとめられたデータによれば、入院していないCOVID-19感染者における糖尿病の合併率は6%だが、集中治療を受けていない入院患者では24%、集中治療を受けている患者では32%になることが報告されている [5] 。 さらに、中国とイタリアにおける報告では、糖尿病があるとCOVID-19感染症が重症化しやすいことが示されている [6] 。
加えて、メタ解析の結果から、糖尿病患者では非糖尿病患者に比べて、COVID-19感染による死亡、重症化、急性呼吸窮迫症候群(ARDS)の相対危険度がそれぞれ2.12、2.45、4.64倍になること、55歳未満や高血圧に罹患していないグループでは、特に糖尿病が強い予後不良の因子となることが明らかにされている[7] 。
糖尿病とCOVID-19感染症重症化との関連性について
糖尿病とCOVID-19感染症の重症化との間には、双方向性の関連性が推定される。
一つは、糖尿病の存在そのものが、COVID-19感染症の重症化に寄与したとの考えである。上記で述べたように、糖尿病患者はウイルス感染症などに対して易感染性を示し、重症化しやすいことが知られている [8] 。 その背景には、高血糖による自然免疫能、獲得免疫能の低下や不適切な炎症応答があげられる [9] 。実際、糖尿病を合併したCOVID-19感染症患者では、リンパ球が減少、好中球が増加し、炎症マーカーであるインターロイキン-6やC-反応性タンパクの血清レベルが高値となり、凝固能の指標であるD−ダイマーが上昇することが示されている [10] 。COVID-19感染患者の臨床データの推移を見た検討では、好中球の上昇はサイトカインストームと関連し、凝固能の亢進や腎機能の低下とともに予後不良の指標となる可能性が示唆されている [11] 。また、糖尿病患者では、慢性腎臓病や心血管病などの併存疾患の合併率も高く、そのためCOVID-19感染に際して病態が重症化したり、死の転帰をとるリスクが高まることも予想される。
一方、急性のウイルス感染症は、正常血糖で正常体重あるいは肥満気味の人に対してもインスリン抵抗性を惹起する [12] 。そのため、COVID-19感染により、インスリン抵抗性が引き起こされ、耐糖能が悪化し、一部の患者において糖尿病が顕在化した可能性も考えられる [13] 。特に重症例では炎症所見が強く、インスリン抵抗性が強く誘導されることから、糖尿病とCOVID-19感染症重症化との関連性に多少なりとも寄与したことが推定される。
COVID-19感染糖尿病患者の管理と治療
COVID-19感染糖尿病患者の管理と治療に関しては、COVID-19感染症の程度が軽症かあるいは無症状で、食事が摂れる患者に対しては、従来通りの糖尿病治療を継続して行う。ただし、急性のウイルス感染により血糖値が高くなることもあり、入院患者においては毎日、血糖値と尿中ケトン体をチェックし、脱水、電解質バランスの異常などに注意を払う [14] 。
在宅療養中の患者に対しては、インスリン注射をはじめとする従来の糖尿病治療を中断しないように説明し、可能であれば血糖値をチェックするように指示し、電話相談など遠隔医療の環境を整備する[15] 。
食事が十分に摂取できない場合は、sick dayのルールに従い治療薬を調整する。乳酸アシドーシス、脱水、正常血糖ケトアシドーシス、消化器症状の増悪などの懸念から、ビグアナイド薬、sodium-glucose cotransporter-2(SGLT2)阻害薬は中止、a-グルコシダーゼ阻害薬、glucagon-like peptide-1(GLP-1)受容体作動薬は原則中止とする [15] 。また、食事量に応じて適宜、スルホニル尿素薬、速効型インスリン分泌促進薬は減量または中止、チアゾリジン薬は中止する必要がある。Dipeptidyl peptidase-4(DPP-4)は、COVID-19の類縁ウイルスであるMERS-CoVの受容体であるが、現時点でCOVID-19との相互作用を示す報告はなく、DPP-4阻害薬は、忍容性も高いため継続可能である [16] 。インスリン治療中の患者においては、治療を中止せず、継続し、適宜インスリン量を増減することが大切である。さらに、COVID-19感染の重症例では、血糖値が高値となり、異化の亢進や脱水などにより、ケトアシドーシスや高浸透圧高血糖症候群による昏睡のリスクも高まることから、感染管理と補液に加え、インスリンを用いた血糖管理を積極的に行う[15] 。糖尿病合併COVID-19感染症患者は、入院28日以内の院内死亡率が高く、COVID-19感染の重症度で補正後も糖尿病患者は、非糖尿病患者に比べて死亡のハザード比が1.49となることが示されている [17] 。さらに、血糖値を頻回に測定して、空腹時血糖値と食後2時間血糖値が70~180mg/dLの範囲に納まる血糖コントロール良好群とそうでないコントロール不良群とに糖尿病患者をわけると、血糖コントロール良好群では、不良群に比して入院期間中一貫して好中球数、C-反応性タンパク、D−ダイマーが低値を示し、ARDSや急性腎不全のリスクが低く、死亡のハザード比が0.14になることが明らかにされている【図表1】 [17] 。このことから、血糖コントロールの程度が、糖尿病合併COVID-19感染患者の予後を予測する一指標になると考えられる。しかしながら、血糖コントロールレベルを70~180mg/dLの範囲に治療介入したとき、糖尿病合併COVID-19感染患者の予後が改善するかどうかは現時点では明らかでない。
| 図表1 |
| 血糖コントロール良好群と不良群の生存曲線:傾向スコア(プロペンシティスコア)で調整した解析 |
| 入院後28日以内の糖尿病合併COVID-19感染患者のカプランマイヤー生存曲線。 青:血糖コントロール良好群。オレンジ:血糖コントロール不良群 |
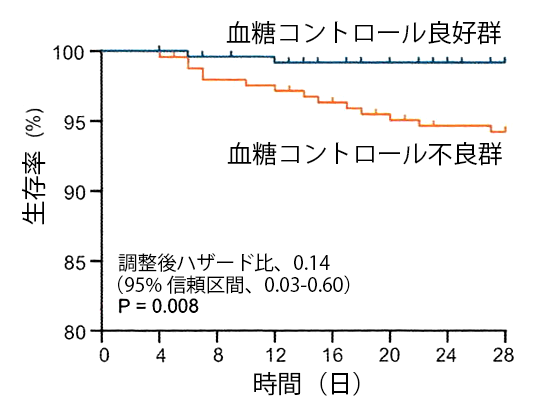 |
| Cell Metab 2020 May 1; doi: 10.1016/j.cmet.2020.04.021のFig. 3 |
[引用文献]
- Diabetes Care 2018 Mar; 41: 513-21
- Hum Vaccin Immunother 2018 Apr 9; 14: 1853-66
- Am J Med Sci. 2016 Feb; 351: 201-11, J Diabetes Investig. 2019 Sep; 10: 1223-8, Vnitr Lek 2019 Winter; 65: 117-24, Metabolism 2020 Apr 28; 154254
- Endocr Rev. 2020 Jun; 41: doi:10.1210/endrev/bnaa011
- 2020 MMWR Morb Mortal Wkly Rep 69:382-6
- J Endocrinol Invest 2002 Mar 28; : doi:10.1007s40618-020-01236-2
- Diabetes Metab Syndr 2020 Apr 17; 14: 395-403
- Lancet Diabetes Endocrinol 2017 Jun; 5: 457-68
- Diabetes Metab Res Rev. 2020 May 31; e3319, Endocr Rev. 2020 Jun; 41: doi:10.1210/endrev/bnaa011
- Diabetes Metab Res Rev. 2020 May 31; e3319, Cell Metab 2020 May 1; doi: 10.1016/j.cmet.2020.04.021
- JAMA. 2020 Feb 7;doi: 10.1001/jama.2020.1585
- Immunity 2018 Jul 17; 49: 164-77
- J Endocrinol Invest 2020 May 2; doi: 10.1007/s40618-020-01276-8
- Diabetes Med. 2020 May 5; doi: 10.1111/dme.14317
- Lancet Diabetes Endocrinol. 2020 Apr 23; doi: 10.1016/S2213-8587(20)30152-2
- Lancet Diabetes Endocrinol. 2020 Apr 23; doi: 10.1016/S2213-8587(20)30152-2, Endocr Rev. 2020 Jun; 41: doi:10.1210/endrev/bnaa011
- Cell Metab 2020 May 1; doi: 10.1016/j.cmet.2020.04.021
