血中タンパクによるCOVID-19重症化の予測
| 杉山真也 | 国立国際医療研究センター |
- COVID-19は、軽症のまま回復する患者と重症化する患者に分かれる。COVID-19の初期に、その後の転帰が予測できれば、限られた医療資源を効果的に利用することができる。
- COVID-19重症化を予測できる血液マーカーを探すために、COVID-19患者の感染初期から回復期までの血液を経時的に収集し、その中の液性因子を網羅的に解析した。それによって、重症化発生前に血中濃度に変化が認められる因子として、CCL17、IFNλ3、IL-6、IP-10、CXCL9を同定した。
はじめに
新型コロナウイルス(SARS-CoV-2)の感染によって引き起こされる新型コロナウイルス感染症(COVID-19)では、その患者の約8割は軽症のまま回復するが、残りの約2割の患者では、酸素投与や人工呼吸器を必要とする重症化へ至ることが明らかとなっている[1]。COVID-19の特徴として、軽症と見られていた患者が翌日には急激に重症化し、死亡にまで至る点があげられる[2]。一方で、重症化患者に対しては、重症化の初期から治療介入できれば、その回復も早まることがわかってきたため、重症化患者をいかに早く囲い込み、治療できるかが重要とポイントである。また、世界的なパンデミックにあるCOVID-19では、各国で患者が急増することによって、医療体制の維持が困難な状況にある。軽症回復者と重症化患者を早い段階で分類できれば、限られた医療資源を効率的に活用できる。
そこで我々は、この重症化予測のマーカーが、臨床検査として測定できれば、広く使いやすいものになると考え、血液中の液性因子を網羅的に解析することで、その因子の同定を進めたので、その概要について解説する[3]。
重症化予測因子の探索(スクリーニング群)
液性因子の網羅的解析
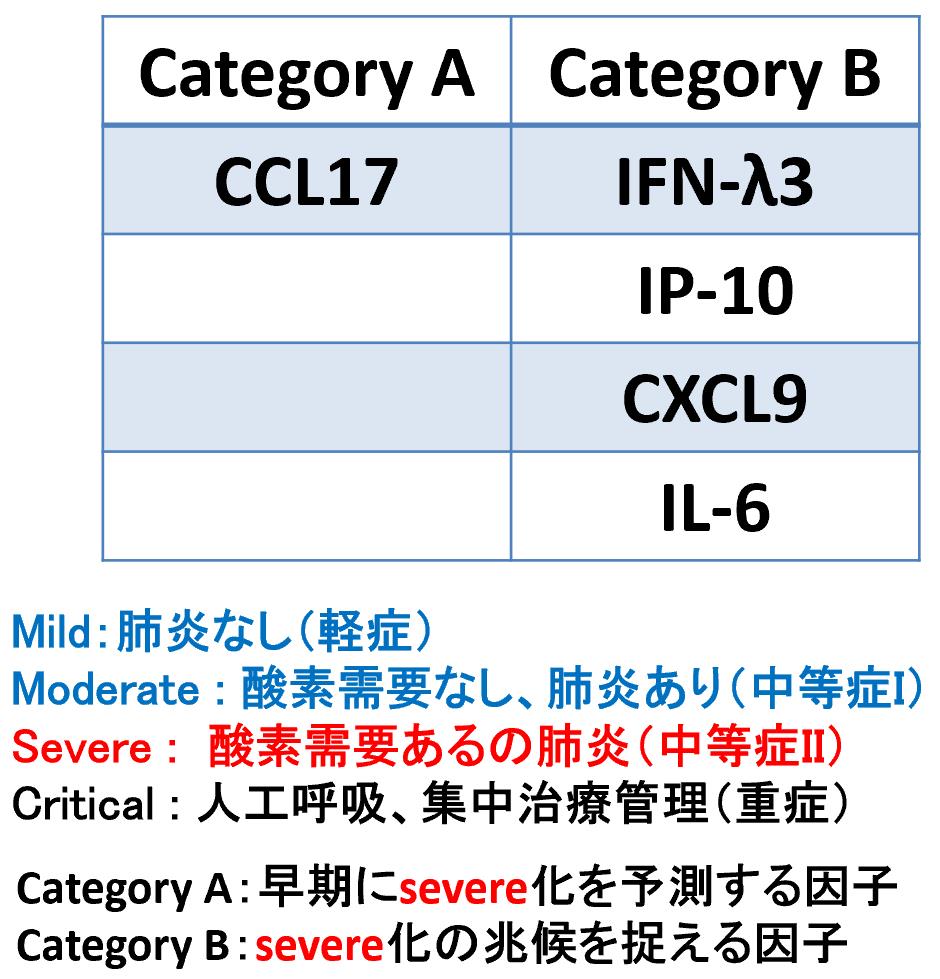
COVID-19の重症化に関連する血液中の2020年1月から3月までに国立国際医療研究センターに入院した患者のうち、入院初期から回復期まで複数回の保存血清を得られた患者を28名エントリーした。感染初期では、いずれの患者も軽症として来院していたが、一部の患者で重症化を呈することとなった。その初期から重症化へ至る過程において経時的に採取された血清を利用して、液性因子の網羅的解析を実施した。液性因子の解析では、71個のサイトカイン、ケモカインを測定した【図1】。その結果、CCL17、インターフェロンラムダ3(IFNλ3)、IL-6、IP-10、CXCL9の血中濃度の変動が、重症化の前兆を取られることに有用であると考えられた【表1】。
| 図1 |
| スクリーニング対象とした液性因子 |
| 今回の研究で液性因子の網羅的解析を行った際に対象とした因子の一覧 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
| 表1 |
| COVID-19重症化の予後予測因子 |
| COVID-19の重症化の予測に有用と考えられた液性因子とその分類 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
その血液中での変動の特徴から大きく2つのグループに分けることができた。SARS-CoV-2感染の初期から重症化の予測に利用可能と考えられる因子をカテゴリーAとし、それにはCCL17が該当した。また、COVID-19重症化が発症する数日前に、血液中の濃度の変動が認められる因子をカテゴリーBとし、そこにはIFNλ3、IL-6、IP-10、CXCL9が該当した。
カテゴリーA:感染初期に重症化予測が可能な因子(CCL17)
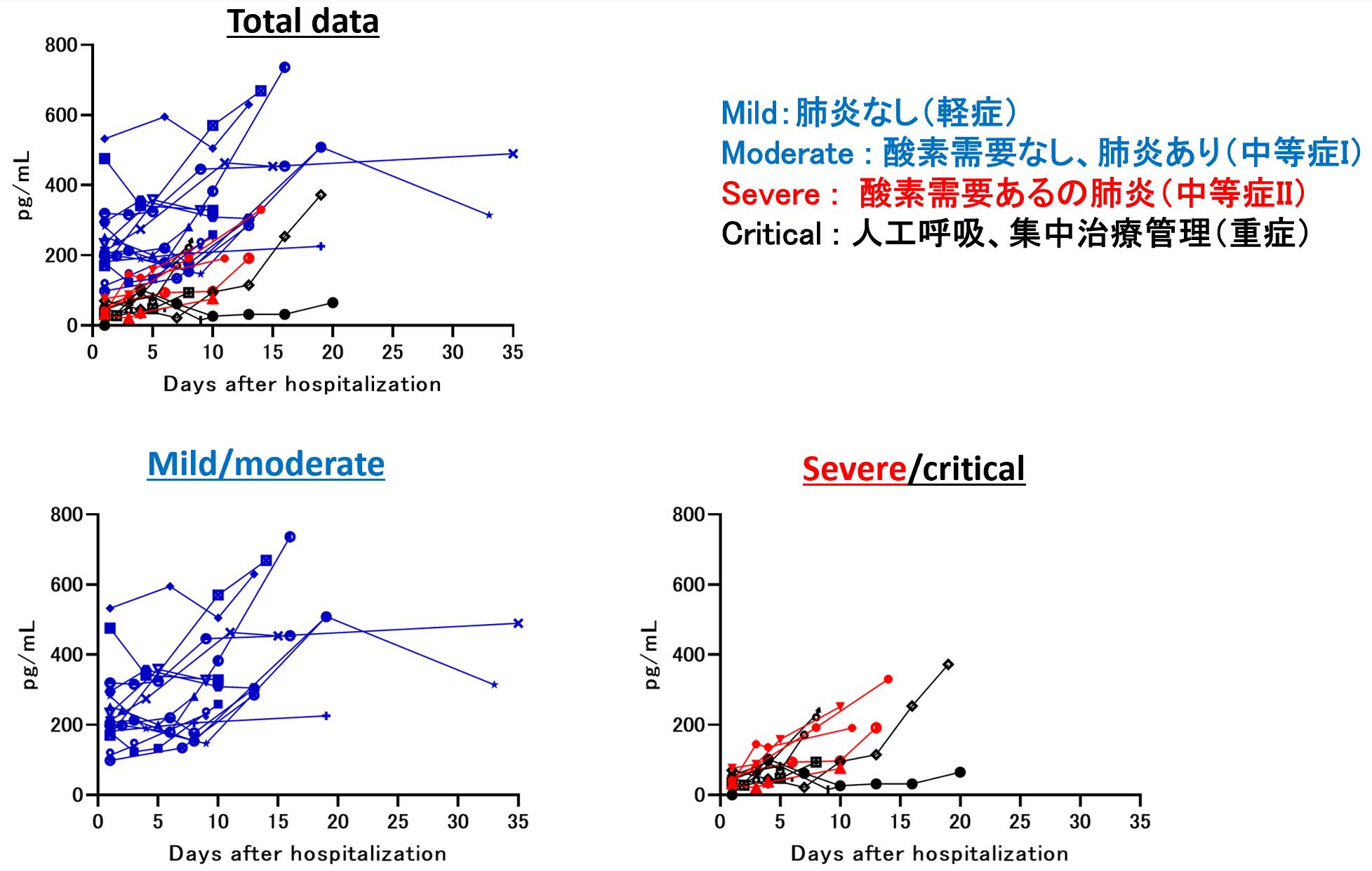
COVID-19患者における、血中のCCL17濃度を経時的に追ったところ、最終的な転帰として軽症回復した患者では、その値が、一定以上の数値を示した【図2】。一方で、感染後に重症化した患者においては、感染初期に低値を示していることが明らかとなった。軽症回復者は、感染から回復期までほぼ高い値を取り続けたが、重症化患者では、重症化とその回復に至る間で、血中濃度が軽症者と近い値まで戻っていくパターンが散見された。ROC解析による重症化予測に最適なカットオフ値は87.5pg/mLであった。
| 図2 |
| CCL17の血中動態 |
| 感染初期から軽症と重症化の間で差が見られるカテゴリーAと分類した因子の特徴を示したグラフ。CCL17は患者の経時的な採血検体から測定され、その血中濃度の推移を示した。Total dataは全患者の一覧。Total dataからMild/moderateだけを抜き出したグラフ(左下)。Total dataからsevere/criticalだけを抜き出したグラフ(右下)。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
カテゴリーB:重症化へ至る数日前に変動を示す因子(IFNλ3、IL-6、IP-10、CXCL9)
一方で、カテゴリーBとした4因子では、カテゴリーAとしたCCL17とは異なる血中動態を示しつつも重症化の前兆を捉えることにおいて有用であると考えられた。代表として、IFNλ3を例に解説する。IFNλは、ヒトにはIFNλ1、2、3、4の4つがあることが知られている。ただし、IFNλ4遺伝子はアジア人では1%以下の人だけが有する遺伝子であるため、今回の解析からは除外した。これらのIFNλ類の配列は、それぞれが非常に高い相同性を有しており、タンパク質として分離定量するには、技術的に困難である。しかしながら、我々はC型肝炎の研究を通して、このIFNλ類を分離定量する技術を有していたため、この分析が可能であった。
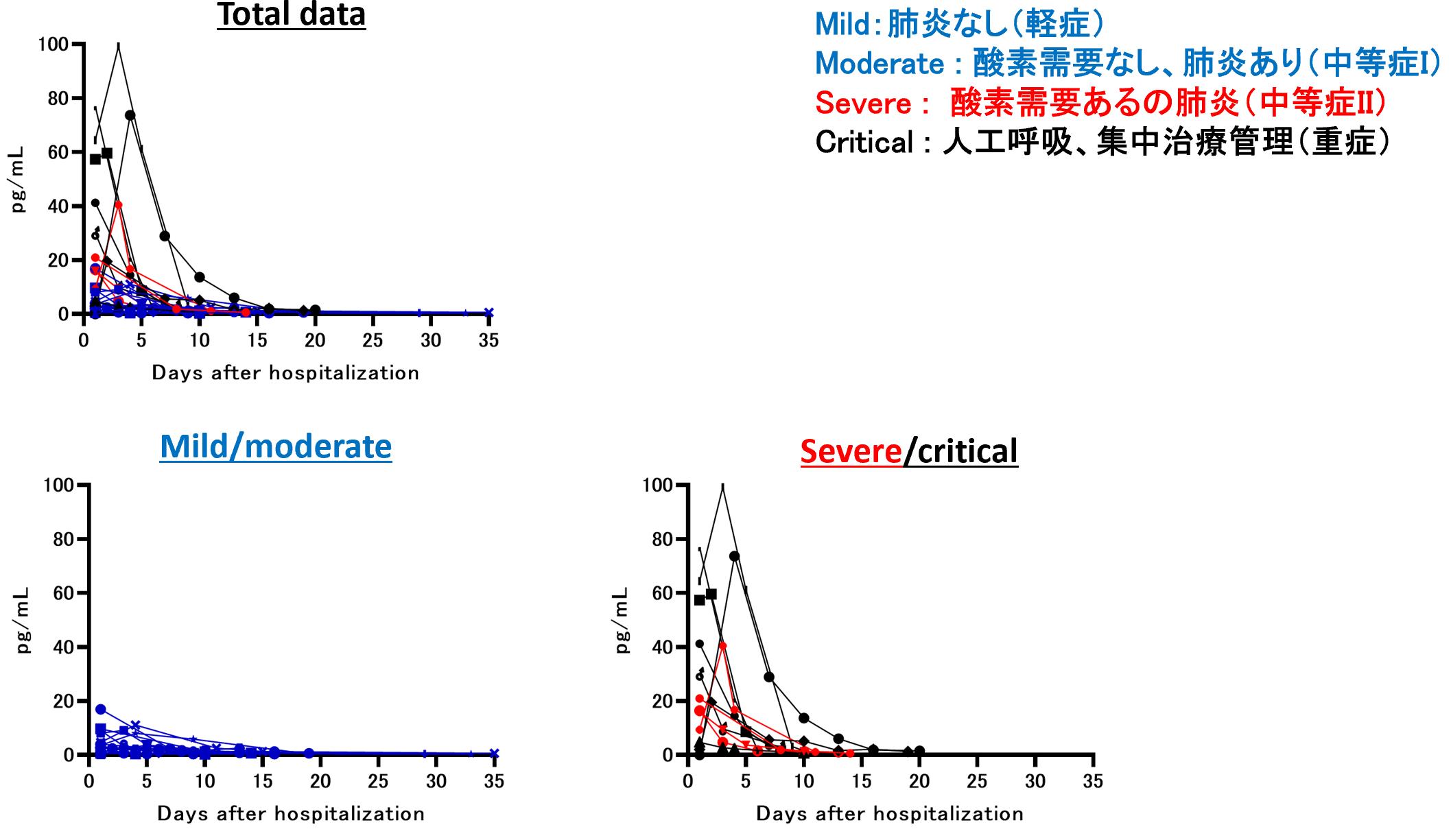
COVID-19の重症化が観察された患者では、このIFNλ類の中でもIFNλ3の血中動態が重症化の予測に有用であった【図3】。重症化した患者では、血中のIFNλ3濃度が急激に上昇し、減衰するという特徴的な挙動が観察された。一方で、軽症回復した患者では、感染初期から回復期にかけて、IFNλ3の血中濃度は一定の低値を取り続けた。ROC解析によると血中のIFNλ3が13.6pg/mLを超えた場合に重症化の予測の的中率が高かった。
| 図3 |
| IFN-lambda 3の血中動態 |
| カテゴリーBと分類した血中動態を示した因子として、IFN-lambda 3、IL-6、IP-10、CXCL9を同定した。代表として、IFN-lambda 3を提示する。患者の経時的な採血検体から得られたIFN-lambda 3の血中濃度の推移を示したグラフ。Total dataは全患者の一覧。Total dataからMild/moderateだけを抜き出したグラフ(左下)。Total dataからsevere/criticalだけを抜き出したグラフ(右下)。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
重症化発生のタイミングとカテゴリーB因子の動態
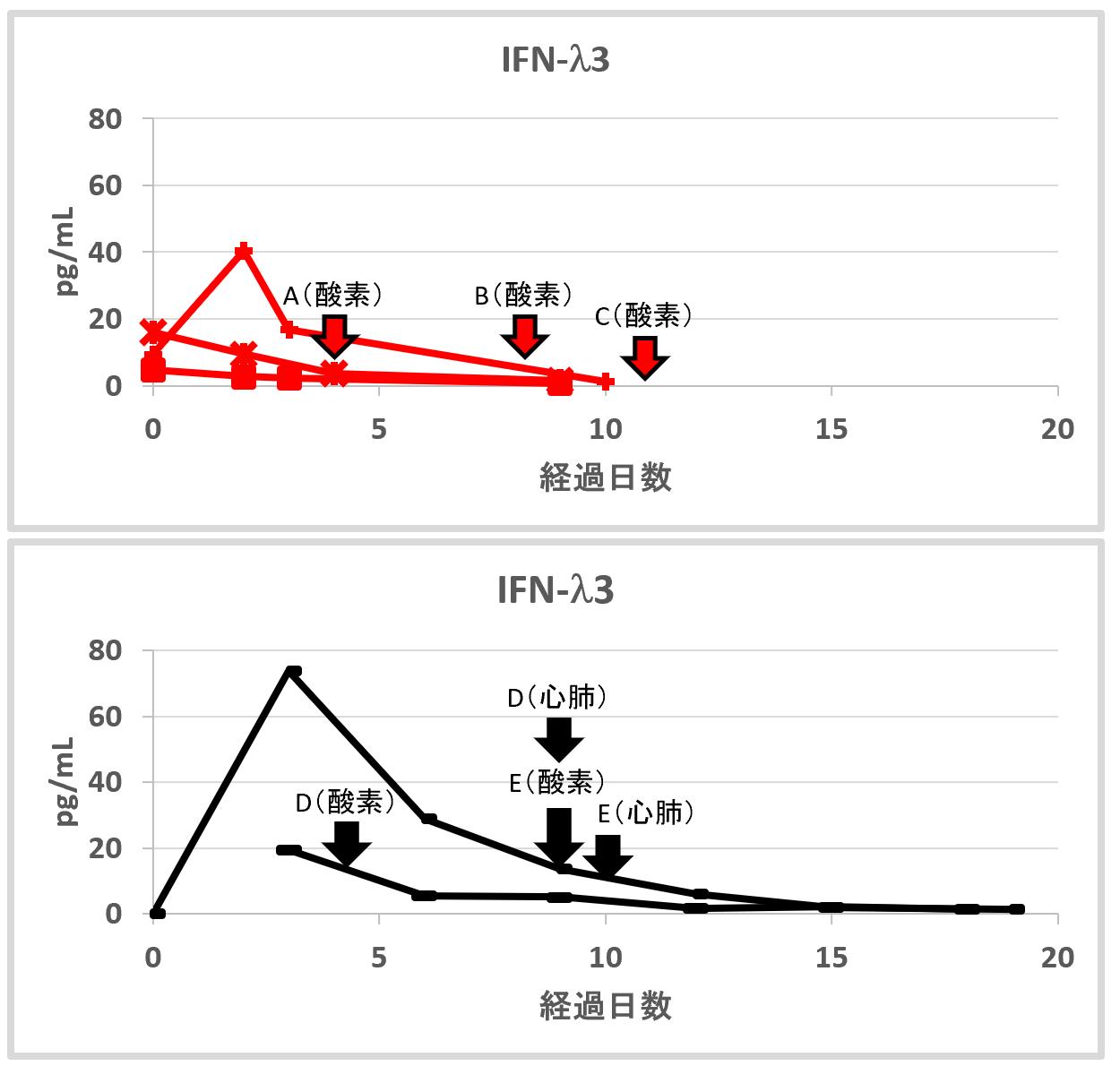
カテゴリーBで見られた特徴的なスパイク状の濃度変化について、臨床症状をあわせて検討したところ、急激な上昇を示したあと、減衰する過程で軽症から重症へ転じていることがわかった。具体的には、減衰する過程の中で酸素投与を必要とする状態へ移行していることが示唆された【図4】。このことは、カテゴリーBで観察されたピーク値とそれに続く減衰過程は、重症化の発症の兆候を示している可能性が考えられた。これらの兆候は、CCL17の動態では観察されないため、カテゴリーAとBは異なる現象を反映するものであると考えられた。
| 図4 |
| カテゴリーBの血中動態と治療経過の関係 |
| 図3から代表的な症例を抜粋したグラフ。症例A~Dの経過を示した。カテゴリーB(IFN-lambda 3を代表として示した)の特徴として、ピークを示した後に減衰する過程を経る。その減衰する過程で酸素需要が発生するような重症化に至ることが示された。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
重症化予測因子の検証(バリデーション群)
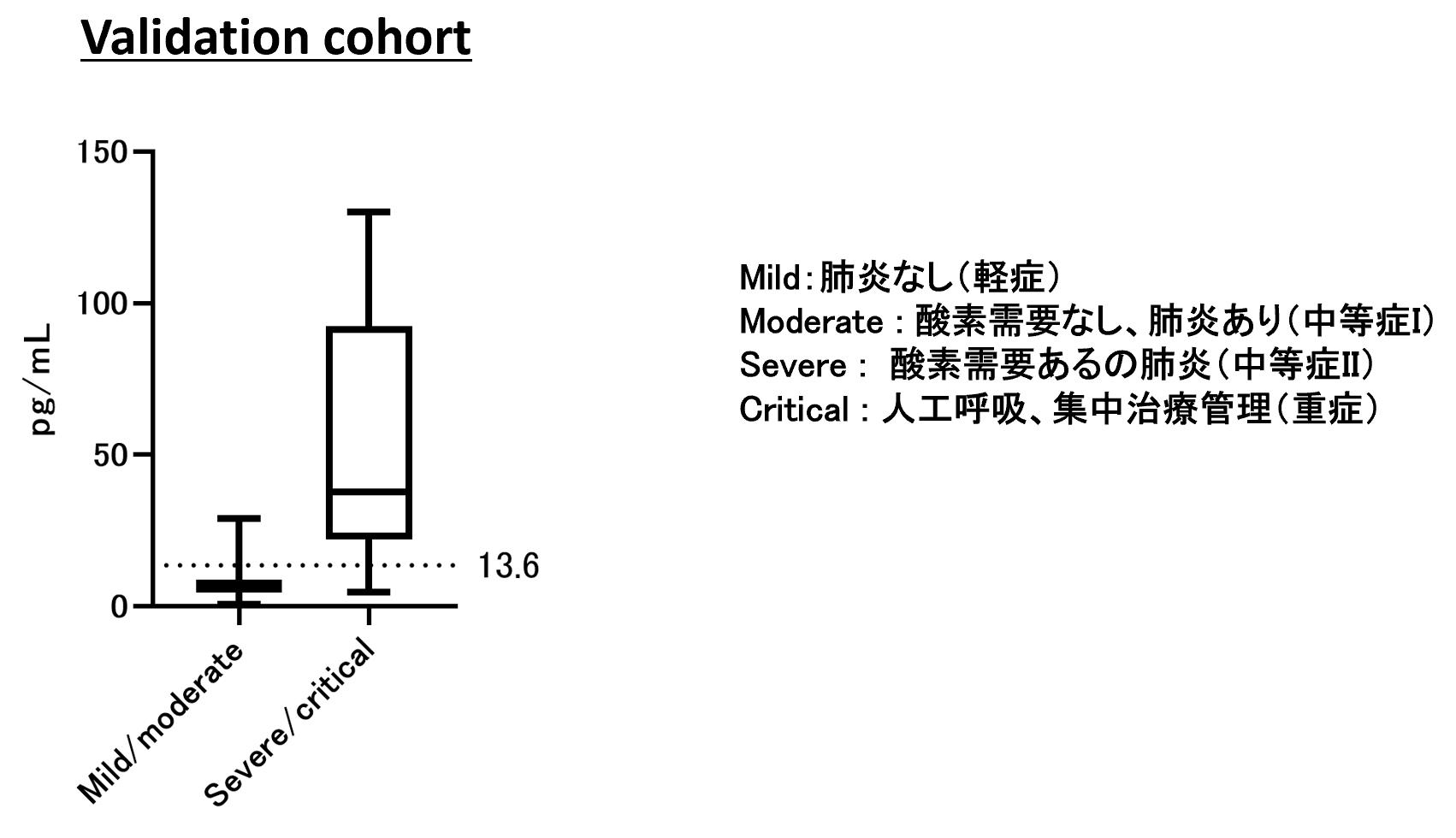
スクリーニング群で抽出した予後予測因子について、独立した58検体で検証実験を行った。バリデーションでは、2020年3月から7月に国立国際医療研究センターへ入院した患者検体を利用した。スクリーニング群と同じく、エントリー時点では、すべての患者が軽症として来院した。来院時のCCL17値を測定した結果、その後重症化した患者で高率にCCL17が低値であり、スクリーニング群の結果が再現された。スクリーニング群で得られたカットオフ値を利用したところ、バリデーション群での重症化予測の感度は83.3%、特異度は93.5%であった【図5】。
| 図5 |
| CCL17のバリデーション結果 |
| スクリーニング群とは独立したバリデーション群でCCL17をつかった重症化の予測効果を評価した。入院初日の血液中のCCL17濃度を測定し、スクリーニング群で決めたカットオフ値で判定した。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
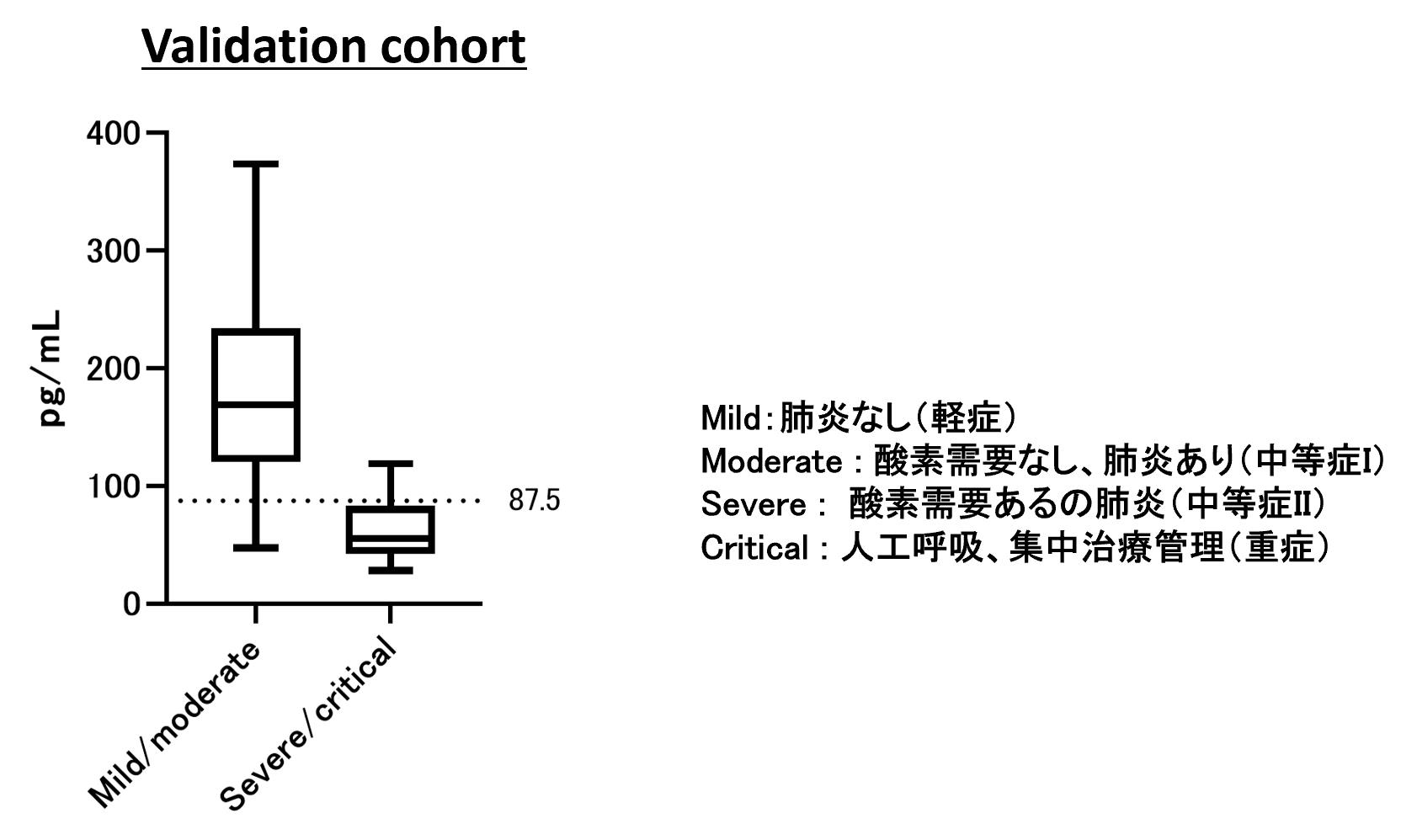
また、IFNλ3の動態に関しては、バリデーション群においてもピークと減衰を示す特徴的な動態を確認した。スクリーニング群で得られたカットオフ値を利用したところ、バリデーション群での重症化予測の感度は79.0%、特異度は84.6%であった【図6】。
| 図6 |
| IFN-lambda 3のバリデーション結果 |
| スクリーニング群とは独立したバリデーション群でIFN-lambda 3をつかった重症化の予測効果を評価した。入院初日から経時的な採血を定期的に行い、その濃度を測定した。重症化前に観察されたIFN-lambda 3の最大値に対して、スクリーニング群で決めたカットオフ値で判定した。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
非COVID-19患者における予後予測因子の血中濃度
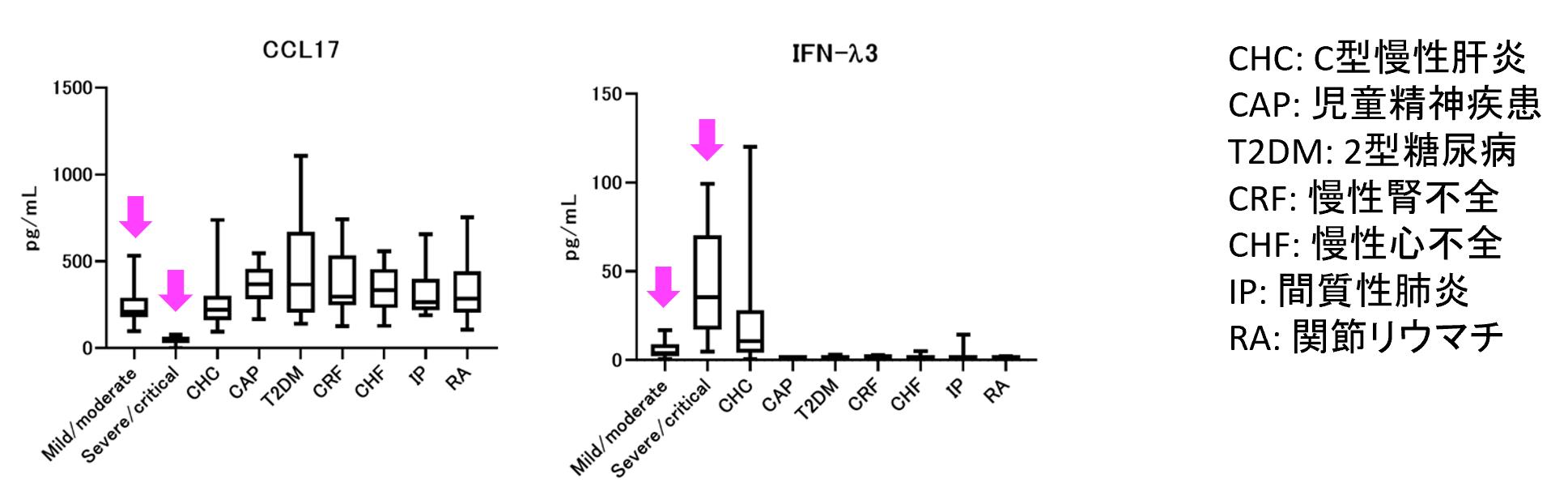
同定した5因子に関して、COVID-19に特徴的なマーカーとなりうるか検討するために、COVID-19患者以外での血中濃度を測定した。エントリーした患者集団は、年齢幅、基礎疾患となりうるものを考慮して、C型慢性肝炎、児童精神疾患、2型糖尿病、慢性腎不全、慢性心不全、間質性肺炎、関節リウマチを選択した。その結果、CCL17に関しては、重症化した患者群でのみ低値を示した【図表7】。一方で、IFNλ3はC型肝炎患者では一部のヒトで高値を示していた。同様に、IL-6は関節リウマチに関連することが報告されているため[4]、COVID-19重症化予測に利用する際は注意を要することが示された(掲載略)。
| 図7 |
| COVID-19以外の疾患での測定値 |
| 基礎疾患になりえる慢性疾患患者でのCCL17とIFN-lambda 3の血中濃度を評価した。矢印で示したグラフはCOVID-19患者のデータで、それ以外はCOVID-19に感染していない患者のデータ。 |
 |
| Gene. 2021 Jan 15;766:145145. doi: 10.1016/j.gene.2020.145145. Epub 2020 Sep 14. PMID: 32941953 |
考察
5因子による予後予測
カテゴリーAとしたCCL17は、感染の早期において、将来の重症化患者を高率で予測しうるものであり、カテゴリーBとしたIFNλ3等の4因子は、重症化発症の数日前に急激に高値となるという性質であった。このことから、SARS-CoV-2の感染後すぐにはCCL17の測定が有効と考えられ、その結果をもとに重症化予備軍を囲い込むことができると考えられた。その重症化予備軍に対しては、重点的な経過観察を行える施設等へ入ってもらうことができれば、軽症段階にある将来の重症者を見逃すことを抑えられる可能性がある。重症化予備軍に対しては、カテゴリーBの因子を経時的に測定することで、その重症化の発生を捉えられる可能性がある。一種の警戒態勢をとることができるため、見逃し等を避けられる可能性がある。
CCL17とCOVID-19
現在のところ、CCL17は、アトピー性皮膚炎の重症化マーカーとして保険収載されている検査項目である[5]。アトピー性皮膚炎では、CCL17が高値となると症状が重症化する。他にも喘息患者では、CCL17が高値となると報告されている[6]。これまでの報告では、健常者の血中CCL17は、400pg/mL前後とされており、今回のCOVID-19の重症化で認めた現象はこれまでとは逆で、従来の報告にはないものであった。これまでのところ、CCL17が低下する詳細な機序は明らかではない。これらの現象は、免疫組織や感染組織が関連する複合的な現象のため、適切な動物モデルを用いた研究が必要でなる。
IFNλ3とCOVID-19
これまでに、急性呼吸窮迫症候群(ARDS)等の重症化肺炎では、IFNλ分子が関連することは報告されている[7]。しかしながら、マウスモデルでの実験となるため、ヒトとIFNλ類とは対応が取りにくいことや、IFNλ類を分離定量することが困難であるため、一括して測定されていた。ヒトにおいても同様であり、IFNλ類が重症肺炎に関連することは示唆されていたが、その責任分子は明らかではなかった。今回、IFNλ類の分離定量することが可能な技術を用いることで[8]、COVID-19の重症化にはIFNλ1、2ではなく、IFNλ3が関連することが明らかとなった。SARS-CoV-2と同じプラス鎖RNAをゲノムに持つHCVでも、IFNλ3が疾患や病態に関連していたことから[9]、HCVとSARS-CoV-2は分類学上は、異なる種となるウイルスであるが、RNAウイルスの何らかの機構が感染や病態の形成で類似していた可能性がある。
IL-6とCRPの関係
IL-6とCRPに関しては、各種疾患で関連が認められることがあるが、なかなか疾患の診断マーカーになりにくいことも知られていた。近年、その理由の一つと考えられる原因が報告された。ヒトの全ゲノム関連解析において、人種によってその存在比率は異なるが、一定の頻度で、健常時においても、IL-6とCRPが遺伝的に高値であるヒトが存在することが明らかとなった[10, 11]。このことは、検査結果に影響するものとなるため、その影響を考慮した結果の解釈が必要となることを意味する。
まとめ
概して、COVID-19患者の自然経過を追うことで、その重症化を予測可能な血液マーカーを同定した。今回の検討では、単施設での解析となっているため、多施設での検討が必要である。現在、多施設共同での前向き試験を計画しており、その中で実臨床における評価を行う。並行して、これらの検査キットを診断薬としての承認申請を進めており、国内の臨床現場で広く使える環境を整えるべく整備を進めている。
[引用文献]
1. Kutsuna S. Coronavirus disease 2019 (COVID-19): research progress and clinical practice. Global Health & Medicine. 2020;2:78-88.
2. Cummings MJ, Baldwin MR, Abrams D, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020.
3. Sugiyama M, Kinoshita N, Ide S, et al. Serum CCL17 level becomes a predictive marker to distinguish between mild/moderate and severe/critical disease in patients with COVID-19. Gene. 2021;766:145145.
4. Houssiau FA, Devogelaer JP, Van Damme J, de Deuxchaisnes CN, Van Snick J. Interleukin-6 in synovial fluid and serum of patients with rheumatoid arthritis and other inflammatory arthritides. Arthritis Rheum. 1988;31:784-788.
5. Kataoka Y. Thymus and activation-regulated chemokine as a clinical biomarker in atopic dermatitis. J Dermatol. 2014;41:221-229.
6. Silkoff PE, Laviolette M, Singh D, et al. Identification of airway mucosal type 2 inflammation by using clinical biomarkers in asthmatic patients. J Allergy Clin Immunol. 2017;140:710-719.
7. Broggi A, Ghosh S, Sposito B, et al. Type III interferons disrupt the lung epithelial barrier upon viral recognition. Science. 2020.
8. Sugiyama M, Kimura T, Naito S, et al. Development of specific and quantitative real-time detection PCR and immunoassays for lambda3-interferon. Hepatol Res. 2012;42:1089-1099.
9. Ge D, Fellay J, Thompson AJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 2009;461:399-401.
10. Dehghan A, Dupuis J, Barbalic M, et al. Meta-analysis of genome-wide association studies in >80 000 subjects identifies multiple loci for C-reactive protein levels. Circulation. 2011;123:731-738.
11. Okada Y, Takahashi A, Ohmiya H, et al. Genome-wide association study for C-reactive protein levels identified pleiotropic associations in the IL6 locus. Hum Mol Genet. 2011;20:1224-1231.
