COVID-19ワクチンの開発状況について
| 渡辺 登喜子 | 大阪大学微生物病研究所 |
| 河岡 義裕 | 東京大学医科学研究所 |
| COI: | なし |
- 2020年7月28日付のWHOの報告によると、世界各国において、臨床試験実施中のワクチンが25種類、前臨床段階にあるワクチンが139種類存在する。
- 開発中の主なワクチンとしては、下記の5種類が挙げられる。
- アデノウイルスベクターワクチン
- mRNAワクチン
- DNAワクチン
- 不活化ウイルスワクチン
- 組換え蛋白質ワクチン
- 開発が先行しているのは、英国のオックスフォード大学とアストラゼネカが共同開発しているアデノウイルスベクターワクチン「AZS1222」、米国の国立アレルギー感染症研究所(NIAID)とモデルナ社のmRNAワクチン「mRNA-1237」、および、中国のカンシノ・バイオロジカル社と北京バイオテクノロジー研究所のアデノウイルスベクターワクチン「Ad5-nCoV」である。これらのワクチンは、現在、第III相臨床試験に入っている。
- 日本国内においても、複数のワクチン開発プロジェクトが進行している。大阪大・アンジェスのDNAワクチンは6月30日に第I/II相臨床試験を開始した。第一三共はmRNAワクチン、塩野義製薬は組換えタンパクワクチン、KMバイオロジクスは不活化ウイルスワクチン、BIKEN財団は複数の試作ワクチン(ウイルス様粒子(VLP)ワクチン、不活化ワクチン、生ワクチン、遺伝子組換えワクチンなど)の開発研究を行なっている。
COVID-19パンデミック:世界および日本における感染状況
2019年末に中国で発生した新型コロナウイルス感染症(COVID-19)は瞬く間に世界中に広がり、2020年3月11日、世界保健機関(WHO)は、COVID-19の感染拡大がパンデミック(世界的大流行)に該当すると評価した。世界各国における対応も虚しく、パンデミックの勢いは一向に衰えず、7月29日現在のWHOの発表によると、世界全体の累計感染者数は1656万人であり、死亡者数は65万人以上にものぼる。
米国における新規感染者数は、6月に入り2万人を下回ったが、6月下旬より再び増加し、7月17日には7万7000人以上を記録した。ブラジル、インドにおいても、5月以降、1日の新規感染者数は増加の一途をたどっており、流行の中心が南米、南アジアにも移っていることが分かる。
7月29日現在の厚生労働省の報告によると、日本におけるCOVID-19の累計感染者は32,459例、死亡者は1,003名である。2020年1〜3月は中国からの輸入例や海外からの帰国例を中心としたCOVID-19感染が見られ、3月下旬からは市中感染による感染者が増加した。感染拡大を防ぐため、4月7日に日本政府が発令した緊急事態宣言は、5月25日に解除されるまで、50日間程度続いた。その間、外出自粛呼びかけなどの対策が取られ、新規感染者数は、4月半ばにピークを迎えた後は減少した。しかしながら、6月半ば以降、東京都を中心に再び新規感染者の数が増えており、東京都は7月15日に感染状況の警戒レベルを4段階のうち最も高い「感染が拡大していると思われる」に引き上げた。
COVID-19ワクチンの開発状況
臨床試験中の主なCOVID-19ワクチンについて
COVID-19の制圧は喫緊の課題であるが、未だに効果的な治療薬やワクチンは実用化されていない。そのため、世界各国において、治療薬やワクチンの開発研究が急ピッチで進められている。2020年7月28日付のWHOの報告によると、世界各国で、臨床試験に入っているワクチンが25種類、さらに前臨床段階にあるワクチンが139種類存在する【図表1】。今年中の実用化を目指して、既に第III相臨床試験に入っているワクチンもある。
開発中の主なワクチンとしては、アデノウイルスベクターワクチン、mRNAワクチン、DNAワクチン、不活化ウイルスワクチン、組換え蛋白質ワクチンが挙げられる。これらのワクチンのうち、開発が先行しているのは、英国のオックスフォード大学とアストラゼネカが共同開発しているアデノウイルスベクターワクチン「AZS1222」、米国の国立アレルギー感染症研究所(NIAID)とモデルナ社のmRNAワクチン「mRNA-1237」、および、中国のカンシノ・バイオロジカル社と北京バイオテクノロジー研究所のアデノウイルスベクターワクチン「Ad5-nCoV」である。
| 図表1 |
| 臨床試験を実施中の主なCOVID-19ワクチン |
| WHOの報告によると、現在、世界各国で、臨床試験に入っているワクチンが25種類、さらに前臨床段階にあるワクチンが139種類存在する。 表では、7月28日のWHOの資料(Draft landscape of COVID-19 candidate vaccine. World Health Organization. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines)に基づいて、主なワクチンを示した。 |
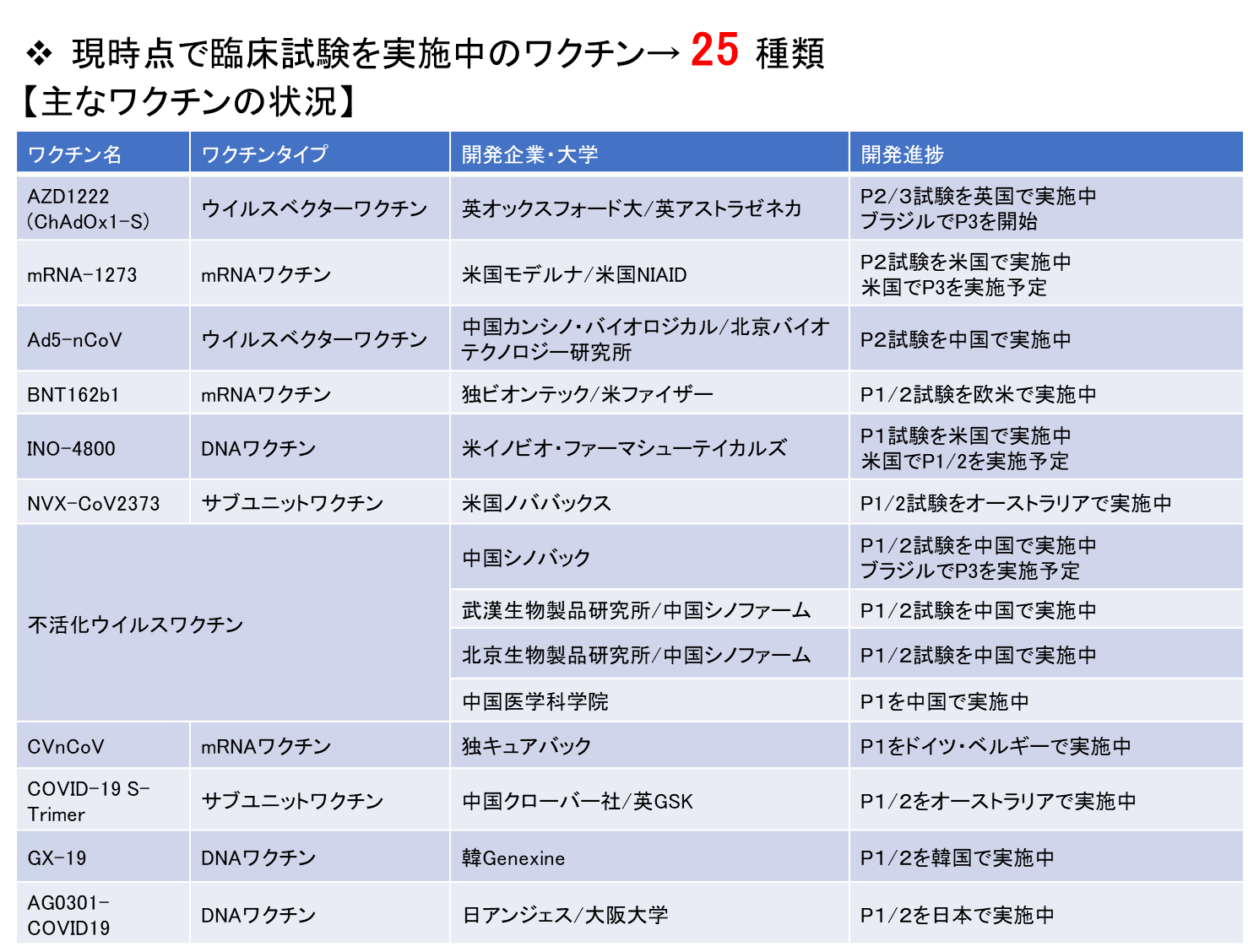 |
アデノウイルスベクターワクチン
アデノウイルスは約36キロベースの2本鎖DNAをウイルスゲノムとして持つ、非エンベロープ型のウイルスである。アデノウイルスベクターは、遺伝子導入効率が優れており、遺伝子治療用ベクターとして汎用されているとともに、様々なウイルス感染症に対するワクチンベクターとしても注目されている。
英国オックスフォード大学の研究グループは、チンパンジーアデノウイルスベクター(ChAdOx1)を用いたCOVID-19ワクチン(ChAdOx1-nCoV-19)の開発研究を行なっている。ChAdOx1-nCoV-19では、アデノウイルス蛋白質の合成を誘導する初期遺伝子であるE1領域が、新型コロナウイルス(SARS-CoV-2)のスパイク(S)蛋白質をコードする遺伝子に置き換えられている。そのため、ChAdOx1-nCoV-19を接種した動物の体内において、S蛋白質が作られるため、それに対する免疫が誘導される。研究グループは、アカゲザルモデルを用いて、ChAdOx1-nCoV-19のワクチンとしての有効性を示した[1]。
2020年4月に、英国の製薬会社アストラゼネカとオックスフォード大学は、COVID-19ワクチン「AZD1222」(ChAdOx1-nCoV-19)の開発・販売について提携することを発表した。4〜5月に英国にて実施された「AZD1222」の第I/II相臨床試験では、ワクチン接種群において、SARS-CoV-2に対するIgG抗体や中和抗体の量の上昇が認められた。また「AZD1222」を接種した人のうち約70%が頭痛や倦怠感などの症状を訴えたが、重篤な副作用が認められた例はなかった[2]。本ワクチンについては、引き続き英国において、第II/III相臨床試験が行われており、また流行拡大の顕著なブラジルと南アフリカにおいて、第III相臨床試験が開始されている。
現在、日本政府は、「AZD1222」の日本への供給について、アストラゼネカとの協議を進めており、日本での実用化に向けて、8月にも国内において臨床試験を実施することで調整している。
中国のカンシノ・バイオロジカル社と北京バイオテクノロジー研究所では、ヒトのアデノウイルス5型をベースにしたワクチンベクターを用いて、COVID-19ワクチンの開発研究を行なっている。上記のChAdOx1-nCoV-19と同様に、本ワクチンベクターもSARS-CoV-2のS蛋白質をコードする遺伝子を搭載している。ヒトアデノウイルスは世界に広く分布しているため、アデノウイルス5型に対する中和抗体を有する人では、ワクチン効果が低い可能性があるという懸念があったものの、カンシノが中国で行なった第II相臨床試験では、ワクチン群においてSARS-CoV-2に対するIgG抗体や中和抗体の産生が認められた[3] 。
上記2つのアデノウイルスベクターワクチンは、現段階で、最も実用化に近いワクチン候補と言える。しかしながら、一回のワクチン接種に1010個以上もの大量のウイルス粒子を必要とすることや、アデノウイルスに対する抗体が体内にできることにより、ワクチンの繰り返し投与が難しいといった懸念も残る。
mRNAワクチン
mRNAワクチンは、メッセンジャーRNA(mRNA)を体内に直接投与して、mRNAによってコードされた抗原蛋白質を体内において発現させることによって、その抗原に対する免疫を誘導する。したがって抗原蛋白質をコードする遺伝子配列さえ分かれば、迅速にmRNAワクチンを産生することが可能である。mRNAは、ゲノムへの挿入変異リスクがないため安全性は高いが、生体内において不安定で壊れやすいため、その生体内投与には、mRNAを安定に保持し、標的細胞へ輸送するDDS (Drug Delivery System)技術が必要となる場合が多い。DDS技術として、脂質ナノ粒子(LNP; lipid nano-particle)やポリマー粒子などが主に用いられている。
米国のモデルナ社は、米国NIAIDと連携して、COVID-19に対するmRNAワクチンとして、「mRNA-1273」の開発研究を行なっている。本ワクチンの作製においては、SARS-CoV-2のS蛋白質をコードするmRNAを、80~100nmの脂質ナノ粒子(LNP)内に内包する手法をとっている。研究グループは、マウスモデルを用いて、「mRNA-1273」を投与したワクチン群において、SARS-CoV-2に対する中和抗体の量の上昇、T細胞の応答、および感染防御効果が認められた[4]。
モデルナ社が米国において実施した「mRNA-1273」の第I相臨床試験では、2回目のワクチン投与後、全てのワクチン接種者において、SARS-CoV-2に対する中和抗体の量の上昇が認められた。ワクチン接種者の半数以上が、倦怠感、寒気、頭痛などといった症状を訴えており、最も高用量(250ug /ドーズ)のワクチンを接種した15名のうち3名が重篤な副反応が認められた[5]。そのため第II相臨床試験は、1ドーズにつき50ugと100ugのワクチンで進められており、また7月下旬には、3万人規模での第III相臨床試験が米国で開始される予定である。
ドイツのビオンテック社と米国ファイザー社は、LNPに包まれたSARS-CoV-2のS蛋白質のレセプター結合部位(RBD;receptor binding domain)をコードするmRNAワクチン「BNT162b1」の開発研究を進めている。ドイツと米国で実施されている第I/II相臨床試験では、ワクチン接種群において、RBDに対するIgG抗体の量の上昇、SARS-CoV-2に対する中和抗体の産生、およびT細胞の応答が認められた[6,7]。ワクチン投与後に頭痛、倦怠感、寒気といった症状を訴える人もいたが、重篤な副反応は認められていない[6]。7月下旬に第III相臨床試験が開始される予定である。
不活化ウイルスワクチン
不活化ウイルスワクチンは、ウイルス自体を不活化して作製されるものであり、これまでに数多くの感染症において実績があるという点にメリットがある。インフルエンザワクチンの場合、発育鶏卵で大量に増殖させたウイルスを不活化・精製することによって不活化ワクチンを作るが、SARS-CoV-2ではVero細胞などの培養細胞を用いて増殖させたウイルスを不活化し、精製したものを不活化ワクチンとして用いる。したがって、各ウイルスについて、効率的なウイルス産生の条件設定(例:細胞や培地など)や不活化方法の検討などが必要となるため、作製には時間を要する。
不活化ウイルスワクチンの開発を進めているのは、主に中国の企業や研究機関である。中国のシノバック社はいち早く不活化ウイルスワクチン「CoronaVac」を開発し、アカゲザルなどの動物モデルにおいて、ワクチンとしての効果を検証した[8]。シノバックは、中国において第I/II相臨床試験を行い、「CoronaVac」を接種した群において、SARS-CoV-2に対する中和抗体産生が確認されたこと、および重篤な有害事象がなかったことを報告しており、7月に第III相臨床試験をブラジルにおいて開始した。
中国のシノファーム社は、武漢生物製品研究所、および北京生物製品研究所と連携して、不活化ウイルスワクチンの開発研究を進めており、アカゲザルなどの動物モデルを用いてワクチンとしての有効性を示したのち[9]、中国において第I/II相臨床試験を行っている。さらにシノファーム社は、アラブ首長国連邦(UAE)において、1万5千人を対象とした第III相臨床試験を開始している。
DNAワクチン
DNAワクチンは、抗原蛋白質をコードするDNAを投与することによって、体内で抗原蛋白質を作らせ、その抗原に対する免疫を誘導することができる。米国のハーバード大の研究グループは、SARS-CoV-2のS蛋白質をコードするDNAワクチンを接種したアカゲザルにおいて、SARS-CoV-2に対して、中和抗体が産生されたこと、および感染防御効果が認められたことを示した[10]。
米国イノビア社は、SARS-CoV-2のS蛋白質をコードするDNAワクチン「INO-4800」の開発研究を行なっている。同社は、「INO-4800」を接種したマウスおよびモルモットにおいて、SARS-CoV-2に対する免疫応答が誘導されたことを示した[11]。イノビオ社が米国で実施した第I相臨床試験では、36名の被験者のうち、34名において、SARS-CoV-2に対する中和抗体の産生やT細胞応答が認められている。ワクチン接種に関連する重篤な有害事象は認められなかったため、引き続き米国内において、第II/III相臨床試験を実施予定である。
日本国内では、大阪大とアンジェスが開発を進めているDNAワクチン「AG0301-COVID19」について、6月30日より第I/II相臨床試験が始まっている。同試験では、健康成人を対象とした、筋肉内接種における治験薬の安全性および免疫原性の評価を目的とする。目標症例数は30例であり、低用量群15例、高用量群15例による2週間間隔での2回接種を行う。アンジェス社は7月22日に、低用量ワクチンの接種完了、および高用量ワクチン接種を開始した旨を発表しており、初期的な試験結果の公表は2020年秋頃になる見込みである。
組換えタンパクワクチン
組換えタンパクワクチンは、抗原となる蛋白質を遺伝子組換え技術によって作り出し、主に大腸菌、酵母、動物細胞を利用して製造される。様々な抗原蛋白質に対応できる点が、組換えタンパクワクチンのメリットと言える。一般的に免疫原性が低いことが多いので、アジュバントを添加するなどして、免疫原性を上げる必要がある。
米国ノババックス社は、COVID-19に対する組換えタンパクワクチン「NVX-CoV2373」の開発研究を進めている。同社は、SARS-CoV-2のS蛋白質を、バキュロウイルス-昆虫細胞発現系を用いて大量発現させた。精製したS蛋白質を内包したナノ粒子を、アジュバントとともに、マウスとキイロヒヒに接種したところ、SARS-CoV-2のS蛋白質に対するIgG抗体の量の上昇、および中和抗体の産生が認められた[12]。ノババックス社は、現在、オーストラリアにおいて、第I/II相臨床試験を実施中である。
国内でのワクチン開発状況について
日本国内においても、複数のワクチン開発プロジェクトが進行しており、最も進んでいるのが、大阪大・アンジェスのDNAワクチンである。上述の通り、大阪大・アンジェスは、6月30日よりDNAワクチンの治験を開始しており、初期的な試験結果は2020年の初秋には公表される見通しである。
第一三共は、東京大学医科学研究所と共同で、mRNAワクチンの開発研究を進めており、動物モデルを用いた試作mRNAワクチンの薬理評価では、SARS-CoV-2に対する抗体価が上昇している結果が得られている。2021年3月頃の臨床試験開始を目指している。
塩野義製薬は、グループ会社のUMNファーマが有する昆虫細胞などを用いた蛋白質発現技術を用いて、組換えタンパクワクチンの開発を行っている。共同研究先の国立感染症研究所において、抗原候補およびワクチンに添加するアジュバント候補の免疫原性試験が開始されている。同社は2020年内の臨床試験開始を目標としている。
KMバイオロジクスは、国立感染症研究所、東京大学医科学研究所、および医薬基盤・健康・栄養研究所と共同で、不活化ウイルスワクチンの開発研究を行なっている。同社が有する、ウイルスワクチンの開発および実用化に必要なノウハウや設備といった、ワクチン製造プラットフォームを用いて、COVID-19に対する不活化ワクチンを開発する。2020年度内に非臨床試験を終え、臨床試験に進むことを目標としている。
BIKEN財団は、大阪大学微生物病研究所、医薬基盤・健康・栄養研究所、神戸大学、群馬大学等の研究機関と連携して、ウイルス様粒子(VLP)ワクチン、不活化ワクチン、生ワクチン、遺伝子組換えワクチンなど複数の試作ワクチンの開発研究を開始した。非臨床試験において、有効性・安全性の高い候補ワクチンを選定し、BIKEN財団において、臨床試験の実施、および生産体制の整備などを進める予定である。
田辺三菱製薬は、カナダにある連結子会社であるメディカゴ社が、植物由来VLPワクチンを用いた非臨床試験の中間結果において、有望な結果が得られたことを報告した。メディカゴ社は、GSKとDynavaxと提携し、7月からカナダにおいて第I相臨床試験を開始している。第I相試験で良好な結果が得られれば、10月から第II/III相臨床試験を開始する計画である。
[引用文献]
- van Doremalen, N.; Lambe, T.; Spencer, A.; Belij-Rammerstorfer, S.; Purushotham, J.N.; Port, J.R.; Avanzato, V.; Bushmaker, T.; Flaxman, A.; Ulaszewska, M.; et al. ChAdOx1 nCoV-19 vaccination prevents SARS-CoV-2 pneumonia in rhesus macaques. bioRxiv 2020, 2020.05.13.093195.
- Folegatti, P.M.; Ewer, K.J.; Aley, P.K.; Angus, B.; Becker, S.; Belij-Rammerstorfer, S.; Bellamy, D.; Bibi, S.; Bittaye, M.; Clutterbuck, E.A.; et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 2020.
- Zhu, F.-C.; Guan, X.-H.; Li, Y.-H.; Huang, J.-Y.; Jiang, T.; Hou, L.-H.; Li, J.-X.; Yang, B.-F.; Wang, L.; Wang, W.-J.; et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2020.
- Corbett, K.S.; Edwards, D.; Leist, S.R.; Abiona, O.M.; Boyoglu-Barnum, S.; Gillespie, R.A.; Himansu, S.; Schäfer, A.; Ziwawo, C.T.; DiPiazza, A.T.; et al. SARS-CoV-2 mRNA Vaccine Development Enabled by Prototype Pathogen Preparedness. bioRxiv 2020, 2020.06.11.145920.
- Jackson, L.A.; Anderson, E.J.; Rouphael, N.G.; Roberts, P.C.; Makhene, M.; Coler, R.N.; McCullough, M.P.; Chappell, J.D.; Denison, M.R.; Stevens, L.J.; et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. N. Engl. J. Med. 2020.
- Mulligan, M.J.; Lyke, K.E.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.P.; Neuzil, K.; Raabe, V.; Bailey, R.; Swanson, K.A.; et al. Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report. medRxiv 2020, 2020.06.30.20142570.
- Sahin, U.; Muik, A.; Derhovanessian, E.; Vogler, I.; Kranz, L.M.; Vormehr, M.; Baum, A.; Pascal, K.; Quandt, J.; Maurus, D.; et al. Concurrent human antibody and T<sub>H</sub>1 type T-cell responses elicited by a COVID-19 RNA vaccine. medRxiv 2020, 2020.07.17.20140533.
- Gao, Q.; Bao, L.; Mao, H.; Wang, L.; Xu, K.; Yang, M.; Li, Y.; Zhu, L.; Wang, N.; Lv, Z.; et al. Development of an inactivated vaccine candidate for SARS-CoV-2. Science (80-. ). 2020, 369, 77 LP – 81.
- Wang, H.; Zhang, Y.; Huang, B.; Deng, W.; Quan, Y.; Wang, W.; Xu, W.; Zhao, Y.; Li, N.; Zhang, J.; et al. Development of an Inactivated Vaccine Candidate, BBIBP-CorV, with Potent Protection against SARS-CoV-2. Cell 2020, 1–9.
- Yu, P.; Qi, F.; Xu, Y.; Li, F.; Liu, P.; Liu, J.; Bao, L.; Deng, W.; Gao, H.; Xiang, Z.; et al. Age‐related rhesus macaque models of COVID‐19. Anim. Model. Exp. Med. 2020, 3, 93–97.
- Smith, T.R.F.; Patel, A.; Ramos, S.; Elwood, D.; Zhu, X.; Yan, J.; Gary, E.N.; Walker, S.N.; Schultheis, K.; Purwar, M.; et al. Immunogenicity of a DNA vaccine candidate for COVID-19. Nat. Commun. 2020, 11, 2601.
- Tian, J.-H.; Patel, N.; Haupt, R.; Zhou, H.; Weston, S.; Hammond, H.; Lague, J.; Portnoff, A.D.; Norton, J.; Guebre-Xabier, M.; et al. SARS-CoV-2 spike glycoprotein vaccine candidate NVX-CoV2373 elicits immunogenicity in baboons and protection in mice. bioRxiv 2020, 2020.06.29.178509.
