新型コロナウイルス感染症肺炎の臨床
| 長谷川 好規 | 独立行政法人 国立病院機構 理事名古屋医療センター 院長 |
| COI: | なし |
- 新型コロナウイルス感染症の70%〜80%は軽症であり、約20%が中等症以上として酸素投与が必要となる。その中の5%前後が重症化してARDSとなる。
- 発症時には約60%の患者は胸部CTで異常を認めない。発症3〜5日では約90%の患者で胸部異常所見が存在する。胸部CTでは、スリガラス状陰影が肺内に多発する。両側性に存在し、その形状が円形であることや、肺の胸膜下末梢側に存在するなどが特徴的である。
- 乾性咳嗽が初期に見られ、病期が進むと痰を伴うことがある。呼吸不全が進むと息切れ、呼吸困難が出現する。
- 新型コロナウイルス感染症肺炎についてはARDSの治療戦略が重要であり、ARDSへの進行をどのように防ぐかが、人工呼吸器やECMOの使用をへらし、医療現場の負担の軽減、ひいては医療崩壊の抑止につながる。
- 治療の原則は、新型コロナウイルスを排除し、ウイルス増殖を抑制することであるが、ARDS状態における効果は限定的である可能性がある。抗ウイルス薬の開発に加えて、ARDSに対する治療戦略として宿主反応を念頭に置いた治療を検討する必要がある。
はじめに
新型コロナウイルス感染症(COVID-19)の疫学データは国や地域により異なるが、70%〜80%の感染者は軽症であり、約20%が中等症以上として酸素投与が必要となる。その中の5%前後が重症化し、人工呼吸器や人工肺(ECMO;extra-corporeal membrane oxygenation)などの集中治療室(ICU)管理が必要となる[1]。
2020年5月22日版厚生労働省「新型コロナウイルス感染症の国内発生動向」[2]における日本の死亡者数・重症者数は、陽性者数16,513名に対して972名で5.9%である。病理解剖報告では、主な死因は、微小血栓による毛細血管の鬱血を伴うびまん性肺胞傷害(diffuse alveolar damage)による呼吸不全とされ、さらに、多臓器不全の所見が報告されている[3]。このことから、COVID-19の救命には早い段階で呼吸不全を予測し、人工呼吸管理への移行を防止する治療法の開発が望まれる。
新型コロナウイルス感染症肺炎の臨床
COVID-19の発症時(0〜2日)には約60%の患者は胸部CTで異常を認めないが、発症3〜5日では約90%の患者で胸部異常所見が両側肺野に存在する【図表1】[4]。これは病初期の診断としての胸部CTが必ずしも有用でないことを示す。一方で、発症後数日で多くの患者が肺炎像を呈し、経験的にも軽症感染者であっても、PCR陽性患者の多くが肺炎像を有している事実と一致する。
| 図表1 |
| 時間経過における胸部CTの所見頻度 |
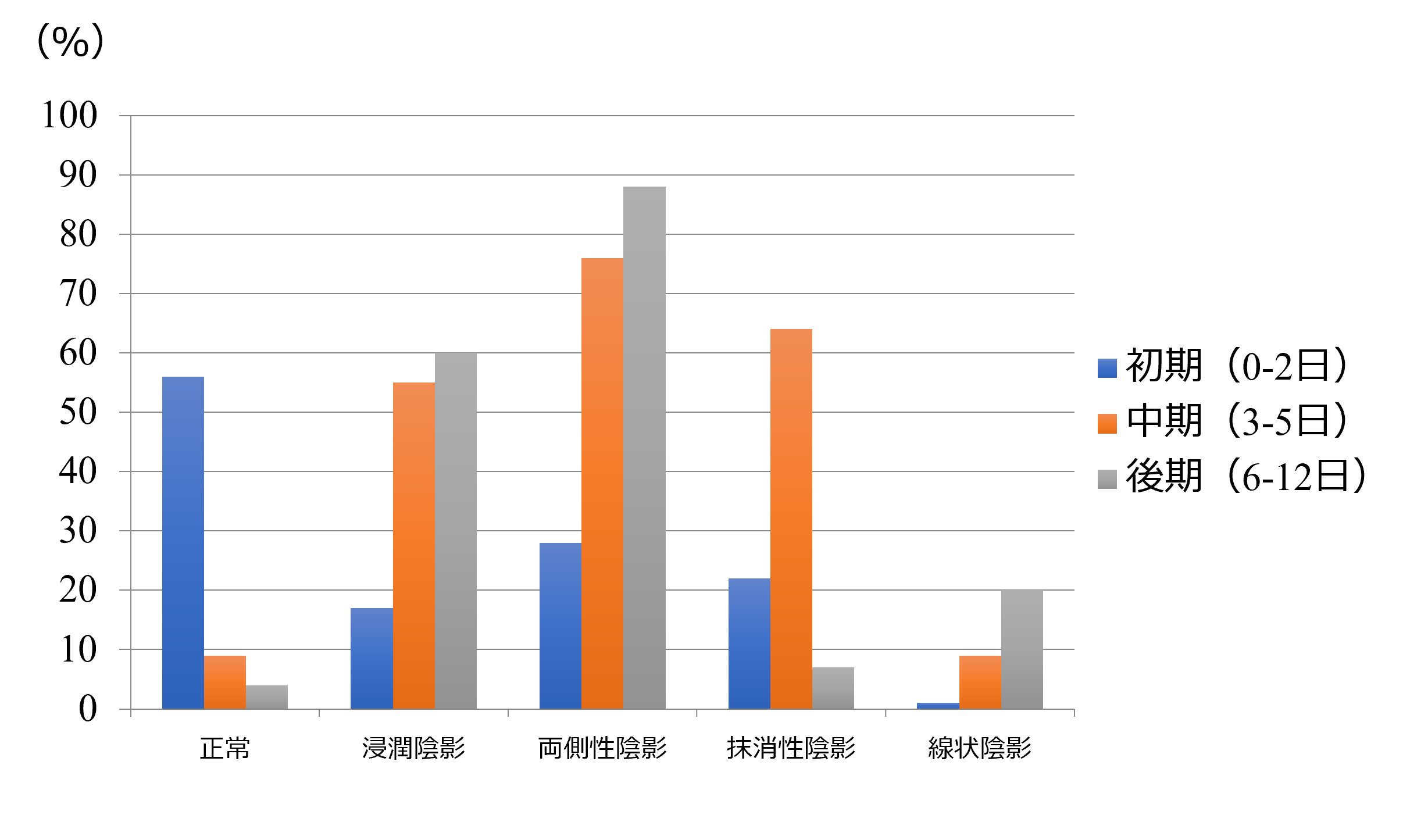 |
| 文献4より引用・改変 |
胸部CTでは、特徴的な所見が報告されている。スリガラス状陰影(Ground-Glass Opacity; GGO)と呼ばれる “気管支、肺血管辺縁を透見出来る程度の肺野濃度の上昇” が、肺内に多発する【図表2-1、図表2-2】。多くは両側性に存在し、その形状が円形であることや、肺の胸膜下末梢側に存在するなどの特徴がある。結核のように好発する肺葉や空洞形成はなく、上葉から下葉までどこにでも発症する。
| 図表2-1 |
| COVID-19による肺炎 |
| 円形を示す多発性のスリガラス状陰影 |
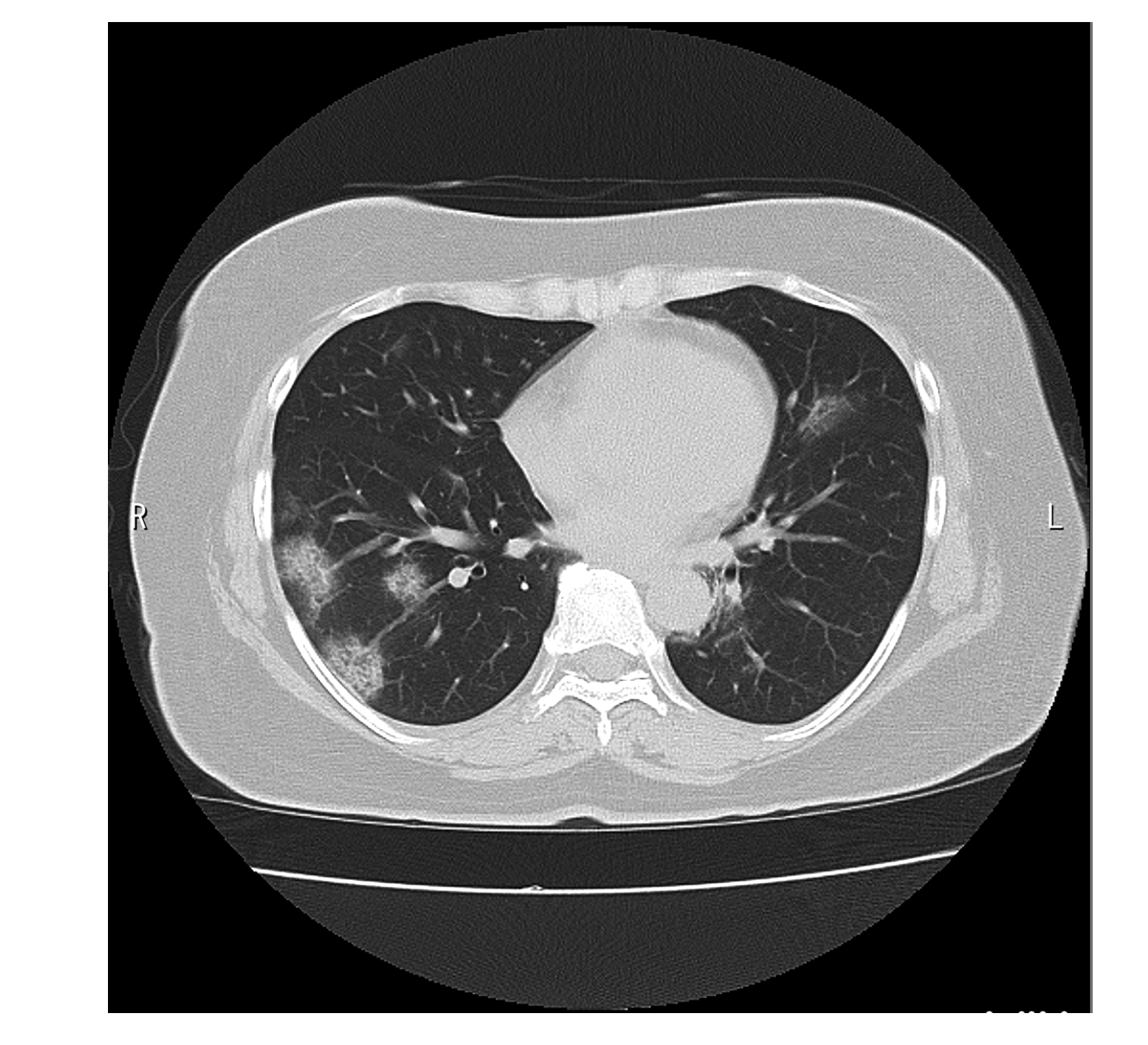 |
| (自験例) |
| 図表2-2 |
| COVID-19による肺炎 |
| 胸膜下末梢側に存在するスリガラス状陰影 |
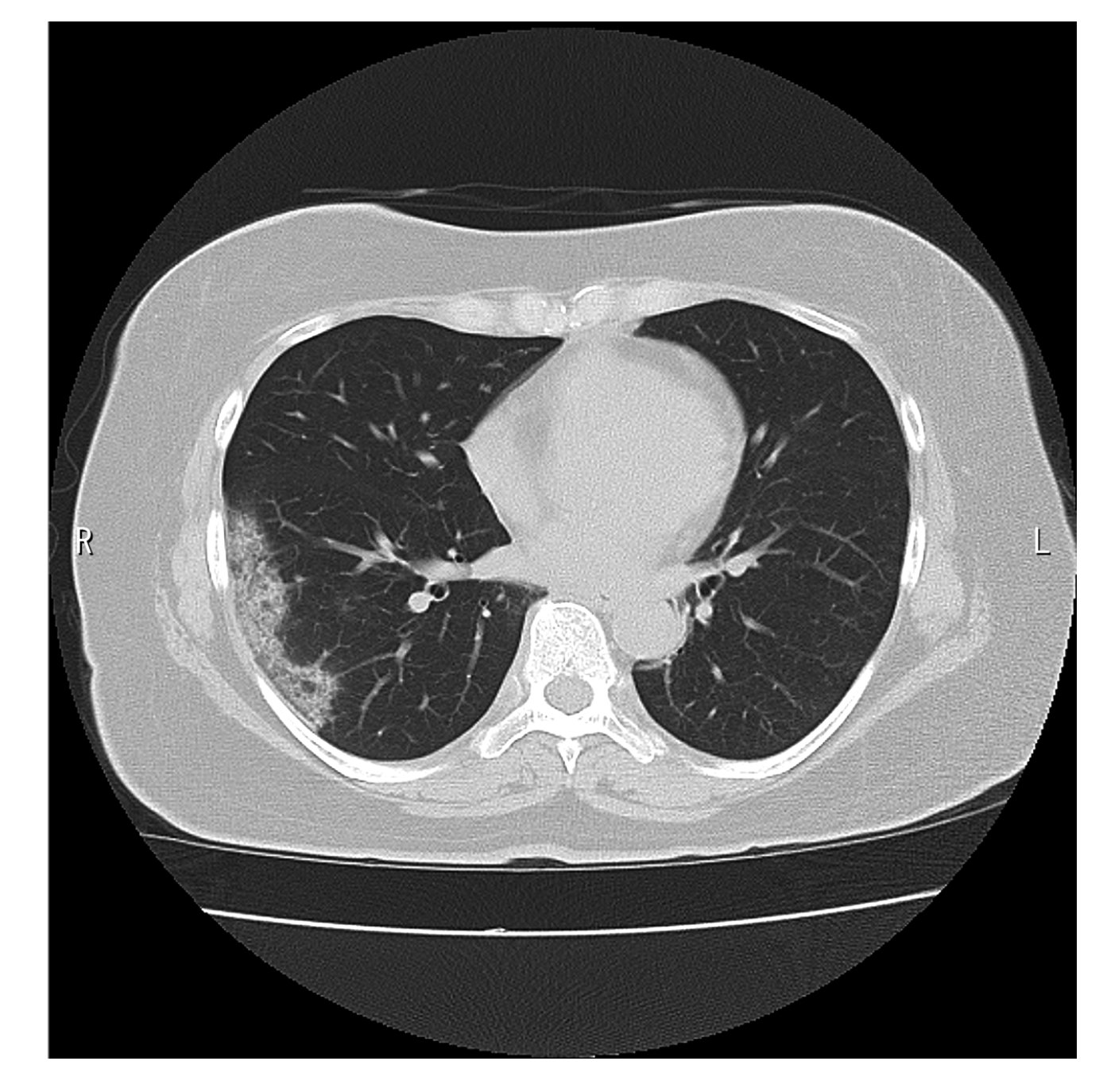 |
| (自験例) |
胸水を示す症例は少なく、縦隔リンパ節腫脹が見られないことも興味深い。また、スリガラス状陰影に浸潤影を伴う場合もあり、浸潤影のみの場合も観察される。細菌感染症に見られるような気管支壁の肥厚、気管支拡張性変化、気道分泌は少なく、小葉中心性粒状陰影もない。
臨床症状は、乾性咳嗽が初期に見られ、病期が進むと痰を伴うことがある。血痰の症例は比較的少なく、呼吸不全が進むと息切れ、呼吸困難が出現する。
新型コロナウイルス感染症肺炎の重症化
肺炎症状が進行すると、急性呼吸窮迫症候群(ARDS)の病態となる。おおよそ感染者の5%程度とされる。
ARDSの病態は2012年に新たに定義され(ベルリン定義)、
- 急性発症(明らかな誘因、症状の出現から1週間以内)
- 胸部画像上の両側性陰影
- 心不全、輸液過剰など溢水以外の原因
- 低酸素血症
の4項目で規定されている。
胸部CTでは、両肺野に拡がるびまん性のスリガラス状陰影ないし浸潤影を呈し、浸潤影の中に気管支透亮像や牽引性気管支拡張像などを呈する【図表3】。COVID-19に関する病理解剖報告においても、主な死因が微小血栓による毛細血管の鬱血を伴うびまん性肺胞傷害とされ、ARDSの病態に一致する。
COVID-19肺炎についてはARDSの治療戦略が重要であるとともに、ARDSへの進行をどのように防ぐのかが、人工呼吸器やECMOの使用を減らし、医療現場の負担の軽減、ひいては医療崩壊の抑止につながる。
| 図表3 |
| COVID-19によるARDS |
| 両側肺野に拡がるびまん性のスリガラス状陰影と浸潤影を呈し,浸潤影の中に気管支透亮像を見る |
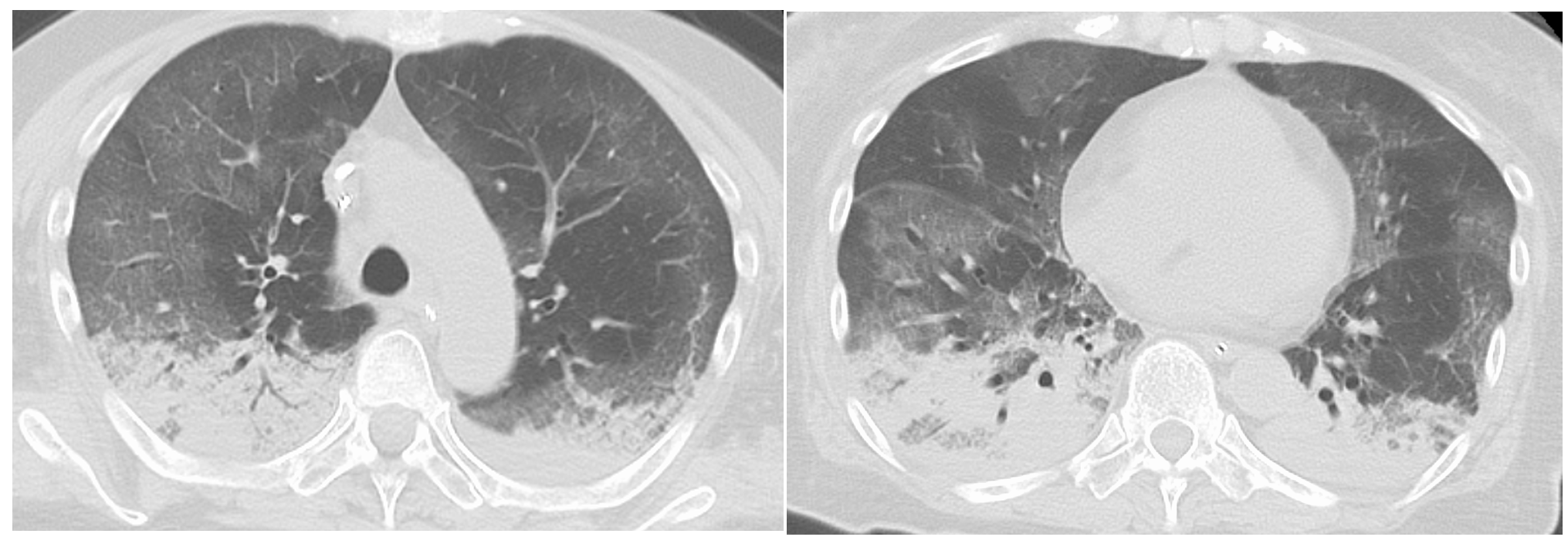 |
| (公立陶生病院 近藤康博先生より供与) |
重症新型コロナウイルス感染症肺炎の治療戦略
疾患治療の原則は原因を取り除くことである。COVID-19肺炎においても新型コロナウイルスを排除し、ウイルス増殖を抑制することである。様々な抗ウイルス薬の開発が進んでいる。ただし、すでに進行したARDS状態における効果は限定的である可能性がある。
感染初期のウイルス増殖を抑え、ARDSへの進展を抑制するうえでの抗ウイルス薬の治療に加え、急性肺傷害に対する治療戦略を考える必要がある。これまで人に急性肺傷害をきたすことが知られているSARS—コロナウイルスやMERS—コロナウイルス研究から、遺伝子の中にインターフェロンなどの制御に関わる遺伝子や、ホストの免疫応答、ウイルスの免疫回避に関わる遺伝子の存在が報告されている[5]。このことから、重症COVID-19肺炎に対する治療において、抗ウイルス薬の開発に加え、宿主免疫の修飾を念頭に置いた治療法の開発が求められる。
ステロイド治療の考え方
重症肺炎に対するステロイド治療の是非は、古くから繰り返されてきた。一般的に、ステロイド療法は、ウイルスの陰性化遅延、抗体産生低下や免疫力低下、高血糖等の副作用が懸念される。過去のインフルエンザ、SARS、MERS感染における報告では、有効性が示されずむしろ有害であるとして、WHOはCOVID-19肺炎では臨床研究以外、使用しないように勧告した[6]。しかし、根拠の論文は限られた研究に基づいており、十分なエビデンスがあるとは言えない【図表4】[7]。
| 図表4 |
| COVID-19肺炎のステロイド治療に否定的なエビデンス |
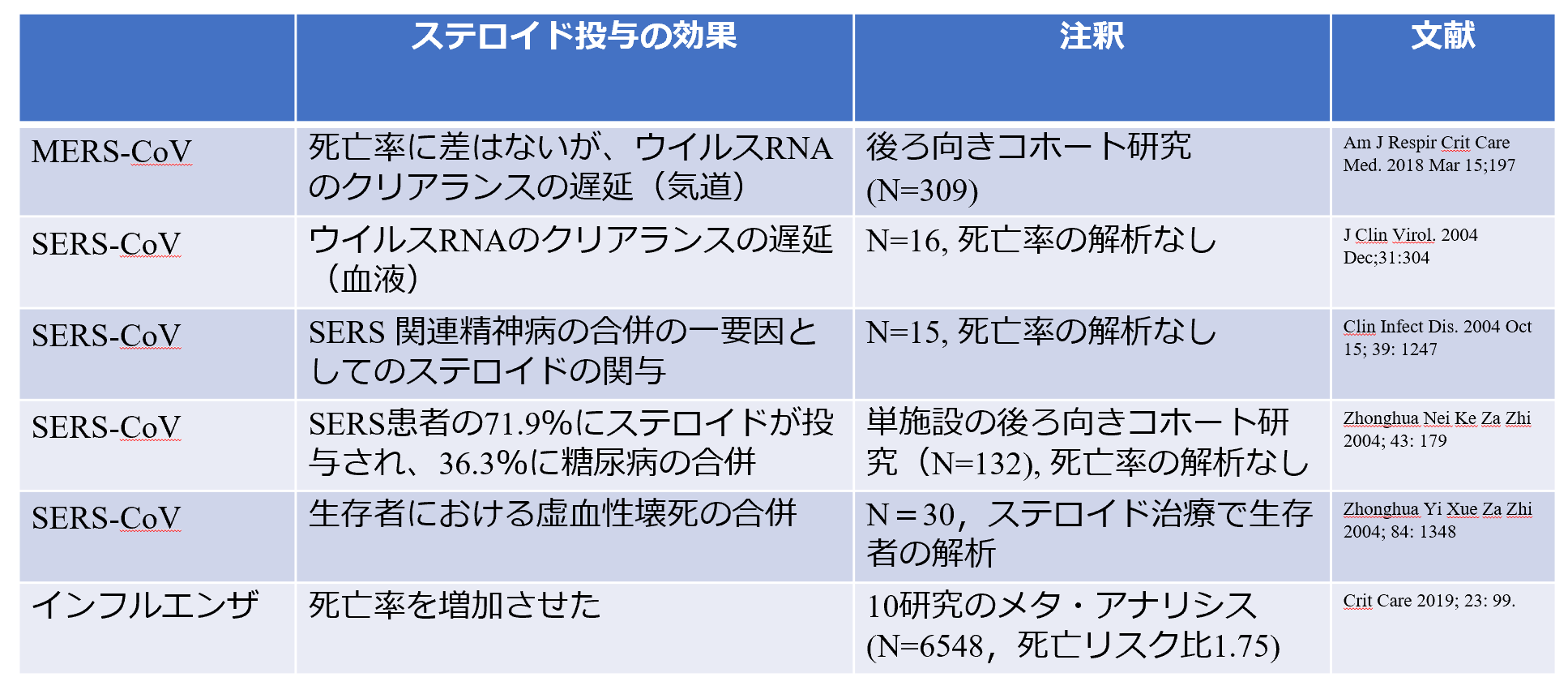 |
| 文献7 Lancet Feb 15, 2020;473-475 より引用・改変 |
武漢の後ろ向きコホート研究で、ステロイド療法による予後改善効果が報告された【図表5】[8]。この結果を受け、中国のCOVID-19に関する治療ガイドラインではその使用を推奨している[9]。しかその根拠は後ろ向きコホート研究のみであり、エビデンスとしては不十分である。
| 図表5 |
| COVID-19肺炎に対するステロイドの治療効果 |
| 中国武漢での201名のCOVID-19肺炎患者の後ろ向きコホート研究。ステロイド治療群のOverall survival が良好であった。(青線:ステロイドグループ、黄線:ステロイドなしグループ) |
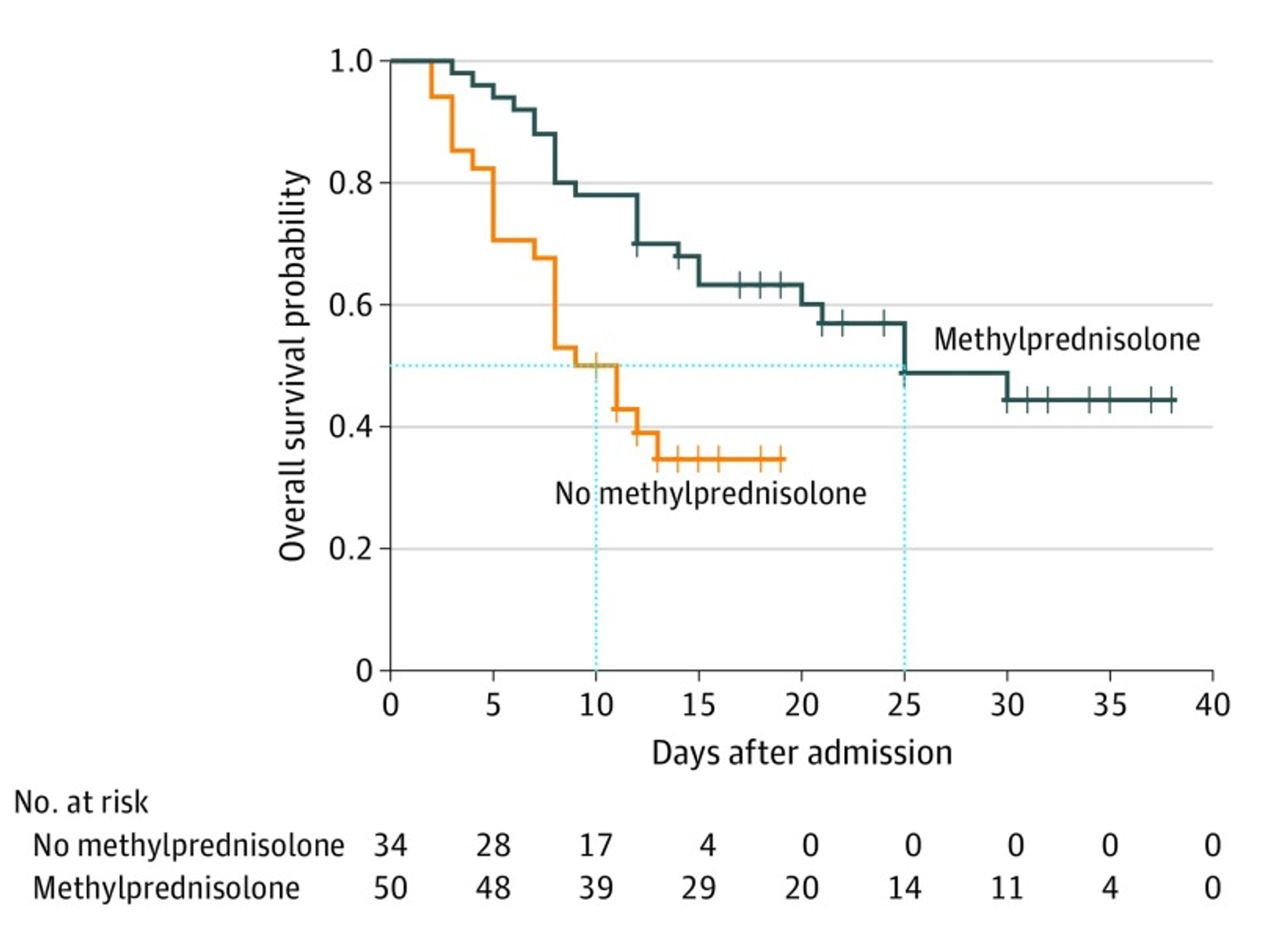 |
| 文献8 JAMA Intern Med. 2020 Mar 13;e200994 より引用 |
本年、ARDSに対するステロイドの治療効果が大規模ランダム化比較試験により報告された【図表6】[10]。敗血症ショックに対するステロイドに関しては、限定的な推奨がガイドラインで記載されている[11]。
| 図表6 |
| ARDSに対するステロイドの治療効果 |
| 大規模ランダム化比較試験により、低用量ステロイドがARDSの予後の改善を示した。(赤線:ステロイドグループ、青線:コントロールグループ) |
 |
| 文献10 Lancet Respir Med 2020; 8: 267‒76 より引用 |
このような背景の中で、現時点でのCOVID-19肺炎に対するステロイドの位置づけはまだ不明である。現在、1000名を対象とするCOVID-19の呼吸不全患者に対するランダム化比較試験が、デンマークで開始された。
新しい治療への試み
2020年5月23日時点で、病名をCOVID-19、条件をCytokine、Study PhaseをPhase 3として、ClinicalTrials.govで登録されている臨床研究を調べると、36件の登録がヒットした。
既存薬でさまざまな免疫修飾に関わると考えられる薬剤が研究対象となっているが、IL-1,IL-6のシグナル制御に関わる薬剤の研究が精力的に進められている。IL-1受容体拮抗薬、抗IL-6抗体、抗IL-6受容体抗体、そのシグナル系であるJAK阻害薬などが海外で臨床研究として実施されている。
Treatment of COVID-19 patients with anti-interleukin drugs (抗インターロイキン薬によるCOVID-19患者の治療)と題された研究では、呼吸不全で全身性のサイトカイン放出症候群を伴う患者さんを登録対象としている。症例登録基準の中に、フェリチン、LDH、Dダイマー、CRPが高値であることが含まれており、おそらくサイトカイン放出症候群のマーカーとして用いられているが、新型コロナウイルス感染症の病態解明の一層の進展により、臨床研究の理論的裏付けが確固となることを期待したい[12]。
[引用文献]
- Eur Respir J. 2020 Apr 9 : 2000562
- 厚生労働省「新型コロナウイルス感染症の国内発生動向」 https://www.mhlw.go.jp/content/10906000/000632895.pdf
- Histopathology 2020 May 04: doi:10.1111/his.14134
- Radiology 2020 Feb 20 : doi.org/10.1148/radiol.2020200463
- Nat Rev Microbiol. 2019; 17(3): 181–192
- World Health Organization. https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected
- Lancet 2020 Feb 15;473-475
- JAMA Intern Med. 2020 Mar 13;e200994
- https://www.jrs.or.jp/uploads/uploads/files/information/COVID_eiseikennkouiinnkai.pdf
- Lancet Respir Med 2020; 8: 267‒76
- BMJ. 2018;362:k3284
- Science 368 (6490), 473-474
