COVID-19に対する候補薬剤及び開発状況(第2版)
| 國土 典宏 | 国立国際医療研究センター 理事長 |
| 杉浦 亙 | 同 臨床研究センター長 |
| 三上 礼子 | 同 臨床研究センター部長 |
| 渡部 克枝 | 同 臨床研究センター室員 |
| 満屋 裕明 | 同 研究所長 |
| COI: | 杉浦:2019年1月-6月 ViiV Healthcare社員、2019年7月-2020年3月 BioMerieux社員 |
(2020.7.16 update)
- 現在多くの研究者や製薬企業がSARS-CoV-2を克服すべく、治療薬の開発を急調で進めている。同時に、SARS-CoV-2に特異的な薬剤が開発されるまでの繋ぎとして、既存薬の中で治療薬の探索が進められている。
- 2020年7月16日現在、作用機序別に国内外の候補薬剤の開発状況をまとめると、11種類の既存薬、血漿療法、そして血液浄化法に対して43の試験が実施されている。うち、実施中33試験、終了10試験となっている。
- レムデシビル(ベクルリー)は、国際共同プラセボ対照二重盲検比較試験の結果等に基づき、2020年5月7日、特例承認制度にて本邦で初めて薬事承認されたCOVID-19治療薬である。
- ファビピラビル(アビガン)に関しては、国内外において複数の試験が実施されているが、現時点ではCOVID-19に対する有効性を示す論文は発表されていない。
- ロピナビル/リトナビル合剤(カレトラ)に関しては、現時点で有効性を示すデータはなく、治療候補薬としての開発の見込みは低いことが想定される。
- クロロキン又はハイドロキシクロロキン(プラケニル)に関しては、COVID-19に対する有効性が確認できない一方で、重篤な循環器系への有害事象などが報告されたため、米国FDAは両剤の緊急使用許可を取り消しており、COVID-19治療に対して使用することは推奨されない。
- その他の薬剤として、ナファモスタット(フサン)やシクレソニド(オルベスコ)に加え、サイトカインストームを改善する全身投与ステロイドや、抗IL-6抗体、JAK阻害薬等が候補薬として挙げられている。これらの薬剤は、国内外で臨床試験を実施中であるが、現時点では有効性は明らかではない。
- 以上、多くの既存薬がCOVID-19の治療薬候補として臨床試験が進められている。しかし、これらの薬剤はSARS-CoV-2を対象として開発されたものではないため、その有効性は限定的と考えられる。
- 根本的な問題解決のために、SARS-CoV-2特定的な治療薬の開発を期待したい。
はじめに
感染者1036万人、死者51万人、これはWHOが公表している世界におけるCOVID-19の状況である(2020年7月1日現在)[1]。2019年12月31日中国武漢市から発せられた原因不明の重症肺炎の報告[2]を端緒に、SARS-CoV-2は瞬く間に感染を広げ、僅か3ヶ月の間に5大陸全てを席巻、人類史に残るパンデミックを惹き起こしている。
ヒトに感染するコロナウイルスは今までに6種類が報告されている。もっとも身近なものは、いわゆる風邪(common cold)の原因である4種類のCoronavirus HKU1, NL63, 229E OC43である[3,4]。それに加え、2000年の Severe Acute Respiratory Syndrome (SARS) virus [5] と2012年のMiddle East Respiratory Syndrome (MARS) virusがある[6]、今回のSARS-CoV-2 は7番目のヒトコロナウイルスであり、遺伝子的・病態的にSARSに近いと考えられる[7,8]。
SARSは限局的な流行であったために、我々は免疫学的に全くnaiveの状態で、SARS-CoV-2を迎えることとなった。そして治療法も予防法も確立していないため、各国とも、中世のペスト禍のごとく、外出の自粛、国境閉鎖、都市閉鎖などの物理的遮蔽による感染防御措置を取らざるを得ない状況下に置かれた。しかしながら、中世との決定的な違いは、我々は、フレミングによるペニシリンの発見から近年のHIV/AIDSに至るまで、多くの感染症との戦いを克服してきた経験と医学的知識、そして研究基盤を有することである[9,10]。
現在多くの研究者や製薬企業がSARS-CoV-2を克服すべく、治療薬の開発を急調で進めているが、SARS-CoV-2特異的な薬剤が開発されるまでの繋ぎとして、既存薬の中で、少しでもSARS-CoV-2増殖を抑える抗ウイルス薬剤とARDSに対する治療薬の探索を進めている。
本稿は、現在国内あるいは国外において進められている既存薬を中心とした臨床試験について、まとめたものである。
[引用文献]
- 新型コロナウイルス感染症(COVID-19)WHO公式情報特設ページ(https://extranet.who.int/kobe_centre/ja/news/COVID19_specialpage)
- ProMED-mail, “Undiagnosed pneumonia – China (HU): RFI “Published, 2019-12-30 23:59:00 Archive Number: 20191230.6864153.
- Lia van der Hoek et al., Identification of a new human coronavirus. Nature Medicine. 2004;10 (4):368-373.
- Patrick CY Woo, et al., Characterization and Complete Genome Sequence of a Novel Coronavirus, Coronavirus HKU1, from Patients with Pneumonia JVI. 2005;79(2):884–895
- Lee, N. et al. A major outbreak of severe acute respiratory syndrome in Hong Kong. N. Engl. J. Med. 2003; 348:1986–1994.
- Zaki, A. et al., Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N. Engl. J. Med. 2012;367:1814–1820.
- Suliman Khan et al., Emergence of a Novel Coronavirus, Severe Acute Respiratory Syndrome Coronavirus 2: Biology and Therapeutic Options. JCM. 2020; 58(5): e00187-20
- Roujian Lu et al., Genomic characterization and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020; 395: 565–74.
- G.J. Fraenkel et al., Penicillin at the Beginning. Annals of Diagnostic Pathology. 1998; 2(6): 422-424
- Mitsuya H, 3′-Azido-3′-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect of human T-lymphotropic virus type III/lymphadenopathy-associated virus in vitro. Proc Natl Acad Sci U S A. 1985; 82(20):7096-7100.
既存薬を用いたCovid-19治療法開発手順
抗ウイルス薬の開発の一般的な手順を【図1】に示す。
| 図1 |
| 既存薬を用いたCovid-19治療法開発手順 |
| オレンジ:有効性が確定している、黄色:論文報告あり、緑:進行中、グレ-:情報なし |
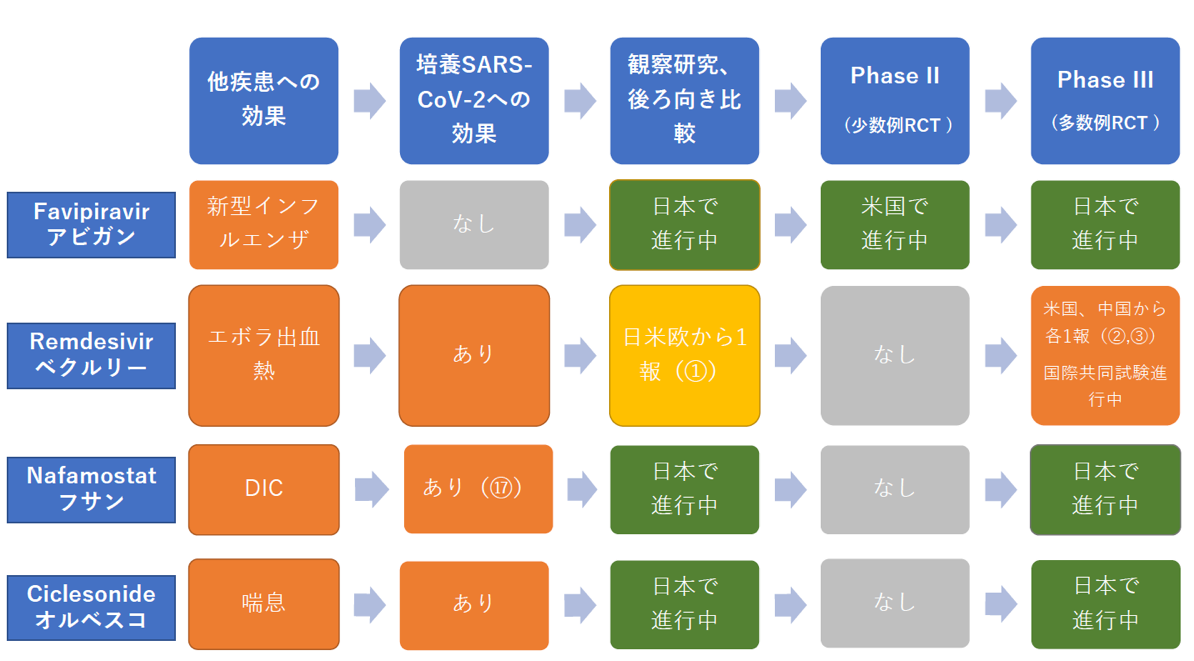 |
候補薬の対象ウイルスへの効果は、まずin vitroで対象ウイルスを感染させた培養細胞(アフリカミドリサル腎臓上皮細胞由来のVero細胞など)に候補薬を投与して検討する。一般にin vitroで抗ウイルス効果のある薬剤のみが臨床試験に進む。厳密には、in vitroで抗ウイルス効果がなくても、ウイルス内での化学的修飾や代謝効果を示すことがあり得る。しかし今回検討されているような低分子化合物では、そのような可能性は非常に低いと思われる。
- Manli Wang. et al., Cell Research. 2020; 30:269–271
- “Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro”
- Wang等はRemdesivir、Fabipiravir, Lopinavir /Ritonavir のSARS-Cov-2に対する抗ウイルス効果を、Vero細胞を用いたアッセイで評価した。SARS-Cov-を感染させたVero細胞に各種候補薬剤を培養液中に投与してウイルス増殖抑制効果が見られたのは、Remdesivirのみで、Fabipiravir, Lopinavir /Ritonavirには効果が見られなかった。Hydroxychloroquineについては、若干の増殖抑制効果がみられたものの、細胞毒性による見かけ上の効果の可能性もある。
- 同様の実験は国立国際医療研究センター研究所満屋研究室でも行われ、ほぼ同じ結果が再現された(未発表データ)。
- Yamamoto M., et al., bioRxiv 2020, 23 Aprildoi: https://doi.org/10.1101/2020.04.22.054981
- “The anticoagulant nafamostat potently inhibits SARS-CoV-2 infection in vitro: an existing drug with multiple possible therapeutic effects.”
- Serine protease阻害剤であるNafamostat Mesilateは、SARS-Cov-2のSタンパク依存的膜融合を1-10nMの範囲で 阻害した。
新規薬剤の場合は、非臨床試験による動物実験での安全性チェックと、Phase I-IIのヒトに投与した場合の安全性チェックおよび用量設定が必要である。既存薬ではヒトへの投与実績があるので、このステップが省略される。
臨床研究では、Randomized Controlled Trial (RCT)による有効性の検証が行われる。エビデンスレベルの高い順に、多数例のRCT(Phase-III)、少数例のRCT (Phase-II)、単アームの観察研究やhistorical controlを対照とした後ろ向き比較研究がある。図に示すように、実際に行われる順番はこの逆であり、単アームの観察研究やhistorical controlを対照とした後ろ向き比較研究が、各薬剤について内外で進行中である。この低いエビデンスレベルの試験で有望な薬剤であると判定されると、次のRCTに進む。RCTの対照群としては、通常は標準治療薬を投与した群が用いられる。しかし現時点ではCOVID-19に対する標準治療薬がないので、抗ウイルス薬を投与しない保存的治療法群が対照群となる。少数例のRCT (phase-II)を経て多数例のRCT (phase-III)に進むことが一般的であるが、いきなりPhaウイルスII RCTを行ったり、Phase II-IIIの形で行われることもある。いずれにしても何らかのRCTで有効性が証明された後に規制当局が承認し、保険収載へと進み、一般臨床での投与が可能となる【表1】。
| 表1 |
| 臨床試験とエビデンスレベル |
| 本文中のエビデンスレベルは本表の分類に従う。 |
| エビデンスレベル Ia 複数のランダム化比較試験のメタ分析による Ib 少なくとも1 つのランダム化比較試験による IIa 少なくとも1 つの非ランダム化比較試験による IIb 少なくとも1 つの他の準実験的研究による III コホート研究や症例対照研究,横断研究などの分析疫学的研究による IV 症例報告やケースシリーズなどの記述研究による V 患者データに基づかない,専門委員会の報告や権威者の意見による |
| 参考:福井次矢「エビデンスに基づく診療ガイドライン」日本内科学会雑誌 第99巻 第12号・平成22年12月10日 |
COVID-19に対する候補薬剤及び開発状況(国内開発を中心に)【表2】
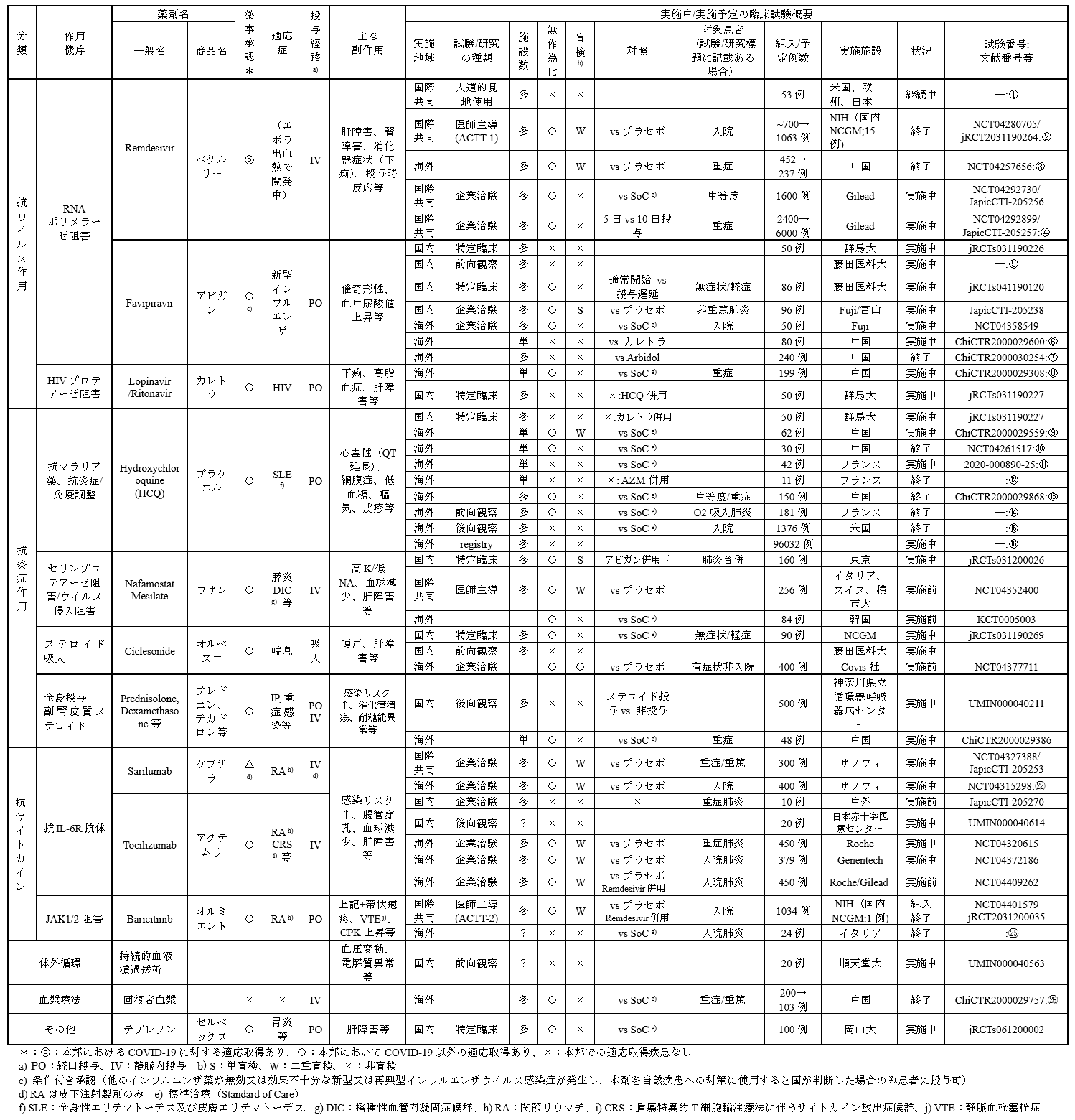
作用機序別に国内外の候補薬剤の開発状況をまとめた。2020年7月16日現在、 11種類の既存薬、血漿療法、そして血液浄化法に対して43の試験が実施されている。
うち実施中:33試験、終了:10試験となっている。二重盲検のデザインを取るものは10試験であり、多くの試験でevidence levelの課題が残る。
| 表2 |
| COVID-19に対する候補薬剤及び開発状況(国内開発を中心に) |
| 作用機序別に国内外の候補薬剤の開発状況をまとめた。11種類の既存薬、血漿療法、そして血液浄化法に対して43の試験が実施されている。うち実施中:33試験、終了:10試験となっている。二重盲検のデザインを取るものは10試験のみである。多くの試験でevidence levelの課題が残る。 |
 |
COVID-19に対する臨床試験の文献紹介
新聞報道等での関心の高いものについて、発表された論文をもとに以下に解説する(番号は表内の番号を示す)。
文献
ベクルリー(レムデシビル)
2020年5月7日に、特例承認制度に基づき国内で薬事承認された。RNA dependent RNA polymeraseを狙った核酸系のプレドラッグ製剤であり、エボラの治療薬として開発された。現時点で、SARS-CoV-2に対する有効性が確認されている唯一の薬剤である。
- ① Grein J, et.at. N Engl J Med. 2020 Apr 10. doi: 10.1056/NEJMoa2007016.
- “Compassionate Use of Remdesivir for Patients With Severe Covid-19.” (https://www.ncbi.nlm.nih.gov/pubmed/32275812)
- まとめ:人道的見地から、入院加療下で少なくとも本剤が1回以上投与されたCOVID-19患者61例のうち、データの解析が可能であった53例(米国22例、欧州又はカナダ22例、日本9例)のデータが取りまとめられた。フォロー期間中(中央値18日)、68%(36/53例)の患者で、酸素療法の状態の改善を認めた。死亡は、13%(7/53例)で認められた。60%(32/53例)の患者で有害事象が認められ、主な有害事象は、肝酵素上昇、下痢、紅斑、腎障害、低血圧等であった。23%(12/53例)の患者で重篤な有害事象が認められ、主な事象は、多臓器不全、敗血症性ショック、急性腎障害、低血圧等であった。
- コメント:この論文からはremdesivirの有効性は判定できない。安全性の確認ができたという点で有益である。
- なお、令和 2年 5 月 7 日付ベクルリー点滴静注液100mg、同点滴静注用100mg審査報告書では、この論文執筆時点よりn数が増えており、少なくとも本剤が1回以上投与されたCOVID-19患者163例のデータが示されている。そこでは47.2%(77/163例)の患者において、酸素療法の状態の改善が認められた。死亡は20.2%(33/163例)と記載されている。
- ② Beigel JH, et.al. N Engl J Med. 2020 May 22. doi: 10.1056/NEJMoa2007764.
- “Remdesivir for the Treatment of Covid-19— Preliminary Report.” (https://www.ncbi.nlm.nih.gov/pubmed/32445440)
- まとめ:米国国立衛生研究所アレルギー・感染症研究所が主体となり実施したレムデシビル国際共同試験(NCT04280705/ jRCT2031190264)の中間解析結果が、論文として発表された。1,063例が1:1の割合で本剤群又はプラセボ群に割り付けられ、606例の回復例が得られた時点で実施された主要評価項目等に関する予備的解析の結果について、レムデシビル投与群(538例)はプラセボ群(521例)に比して、31%回復日数が早かった(p<0.001)。回復に至る日数の中央値は、レムデシビル投与群で11日、プラセボ群で15日であった(ハザード比[95%信頼区間]:1.31[1.12, 1.54]、p<0.001)。一方、死亡率はレムデシビル投与群で8%、プラセボ群で11.6%と、レムデシビル投与群で少ない傾向が認められた(p=0.059)。
- コメント:本論文は、レムデシビル のCOVID-19に対する有効性が確認されたEvidence level Iの最初の論文である。
- ③ Wang Y, et.al. Lancet. 2020 May 16; 395 (10236): 1569-1578. doi: 10.1016/S0140-6736(20)31022-9.
- “Remdesivir in Adults With Severe COVID-19: A Randomized, Double-Blind, Placebo-Controlled, Multicentre Trial.” (https://www.ncbi.nlm.nih.gov/pubmed/32423584)
- まとめ:重症COVID-19患者を対象に中国で実施された多施設共同プラセボ対照二重盲検比較試験では、無作為化後28日目までの臨床状態改善までの時間の中央値[95%信頼区間]は、レムデシビル群(158例)で21[13, 28]日、プラセボ群(79例)で23[13, 28]日、ハザード比は1.23[0.87, 1.75]であった。本試験は中国内のCOVID-19患者数が急速に減少したため、目標被験者数452例の組み入れを達成できず、237例で閉じられた。このため試験の統計学的パワーが低下し、著者らは本試験結果からレムデシビルの有効性を適切に評価できなかった可能があると述べている。
- コメント:レムデシビル はin vitroの評価系でもSARS-CoV-2の複製を抑えることが複数の研究者により確認されているが、Beigel JH 等とWang Y等の結果の乖離は、それぞれの試験の被験者の数が異なり、検出力の差によるためと考えられる。
- ④ Goldman JD, et al. N Engl J Med. 2020 May 27. doi: 10.1056/NEJMoa2015301.
- “Remdesivir for 5 or 10 Days in Patients With Severe Covid-19.” (https://www.ncbi.nlm.nih.gov/pubmed/32459919)
- まとめ:重症COVID-19患者を対象に、標準治療併用下で、レムデシビル5日間投与群と10日間投与群に無作為化した非盲検並行群間比較試験(GS-US-540-5773試験)の速報値が、論文として発表された。主要評価項目は、無作為化後14日目の7点順位尺度評価に基づく臨床状態とされ、臨床状態の改善について、5日間投与群に対する10日間投与群のオッズ比[95%信頼区間]は、0.76[0.51, 1.13]であった。また、5日間投与群及び10日投与群で、それぞれ50%の患者が退院するまでの時間は、10日及び11日、臨床症状改善を認めた患者割合は65%(129/200例)及び54%(107/197例)、回復患者割合70%(140/200例)及び54%(116/197例)、死亡割合は8%(16/200例)及び11%(21/197例)であった。
- コメント:レムデシビルの供給が当面充分でないことを踏まえると、5日投与で10日投与とほぼ同等の臨床効果が期待できるということは、practicalには有意義な結果である。
アビガン(ファビピラビル)
多くの観察研究が行われている一方で、ランダム化比較試験(RCT)が実施されていないために、有効性の評価ができていない。また、藤田医科大学で実施中の観察研究等で報告された安全性に関する情報は、インフルエンザ患者対象に実施された臨床試験での報告と大きく異なる傾向は認められなかったものの、催奇形性の副作用等については、投与期間以上に長く影響を及ぼす可能性もあり、長期安全性についての評価はできていない。
- ⑤ 観察研究中間報告(2020年5月15日時点)(http://www.kansensho.or.jp/uploads/files/topics/2019ncov/covid19_favip_0526.pdf)
- まとめ:報告によると、国内407施設から2,158例が登録され、酸素投与不要の軽症例が45.2%(976例)、酸素投与を要した中等症例が43.9%(947例)、人工呼吸器やECMO管理を要した重症例が10.9%(235例)であった。投与開始7日後、14日後の転帰を「改善」、「増悪」、「不変」の3段階で評価した。その結果、投与7日後及び14日後に、「改善」と判定された患者割合は、軽症例で73.8%(574/976例)及び87.8%(506/976例)、中等症で66.6%(498/947例)及び84.5%(469/947例)、重症例で40.1%(75/235例)及び60.3%(91/235例)であった。投与7日後及び14日後に、「増悪」と判定された患者の割合は、軽症例で13.1%(102/976例)及び5.9%(34/976例)、中等症で21.3%(159/947例)及び8.8%(49/947例)、重症例で28.3%(53/235例)及び25.2%(38/235例)だった。死亡は、軽症例で5.1%(42/976例)、中等症で12.7%(110/947例)、重症で31.7%(71/235例)に認められた。
- 因果関係が否定できない有害事象は24.65%(532/2,158例)に認められ、主な事象は、高尿酸血症・尿酸値上昇 15.52%(335 /2,158例)、肝機能障害・肝機能酵素上昇7.37%(159 /2,158例)等であった。
- コメント:感染症学会ホームページに掲載された「中間報告」であり査読された論文ではない。医療施設の判断によりアビガンをcompassionate useとして投与された入院症例の有害事象と転帰の迅速集計が目的とされており、コントロール群は設定されていない。このため現時点で有効性および安全性の結果の解釈は困難である。
- ⑥ Qingxian Caia et al., Engineering. 2020 Mar 18. doi: 10.1016/j.eng.2020.03.007.
- “Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study” (https://www.sciencedirect.com/science/article/pii/S2095809920300631)
- まとめ:中国の研究グループが「IFN-γ併用下でアビガンとカレトラの効果を比較し、アビガンの有用性を示唆する論文」を発表したが、何らかの理由で一旦論文が取り下げられた。 現在Engineering 誌のホームページ上で再び閲覧できるが、プレプリントの状態にある。取り下げら得た理由も再び掲載された理由も、Engineering 誌からは一切説明がない。
- コメント:Historical controlを用いたEvidence level IIの試験である。アビガン投与群のPCR陰性化までの期間が異常に短く、評価指標について充分吟味する必要がある。
- ⑦ Chang Chen, et.al. doi: https://doi.org/10.1101/2020.03.17.20037432
- “Favipiravir versus Arbidol for COVID-19: A Randomized Clinical Trial.” (https://www.medrxiv.org/content/10.1101/2020.03.17.20037432v4)
- まとめ:中国で実施された240例のCOVID-19患者対象の多施設非盲検無作為化試験で、標準治療併用下で、抗インフルエンザ薬であるUmifenovir(Arbidol)又はファビピラビルを10日間投与した結果、主要評価項目である7日目の症状改善率は、有意差は認められなかったが(p=0.1396)、ウミフェノビル投与群(最終評価例数120例)55.86%と比べ、ファビピラビル投与群(最終評価例数116例)で71.43%と高い傾向が認められたと報告された。この試験ではCovid-19の診断をPCRではなく、肺CT、臨床症状、濃厚接触歴などから総合的に診断している。その結果PCR陽性率は38-46%と著しく低く、COVID-19以外の患者を含んでいる可能性を除外できない。
- コメント:この論文が発表されているmedRxivは、未査読のプレプリントのものを掲載するサイトであり、ホームページ冒頭には
- 「Preprints are preliminary reports of work that have not been certified by peer review. They should not be relied on to guide clinical practice or health-related behavior and should not be reported in news media as established information.」
- と掲載情報の取扱に関する注意事項が記載されている。対照群で用いられているArbitolの評価が不明であり、Arbidolのマイナス作用が仮にあったとすれば、それを検出しただけの可能性も論理的にはあり得る。
カレトラ(ロピナビル/リトナビル合剤)
ロピナビルは、HIV-1のプロテアーゼ阻害剤として開発された薬剤であり、リトナビルも同様である、ただしリトナビルはCYP阻害剤として配合されている。
- ⑧ Cao B, et al. N Engl J Med. 2020 May 7; 382(19):1787-1799. doi: 10.1056/NEJMoa2001282.
- “A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19.” (https://www.ncbi.nlm.nih.gov/pubmed/32187464)
- まとめ:実薬群(99例:ロピナビル400 mg/リトナビル100 mg 1日2回×14日間)における死亡率(19.2%)や集中治療室(ICU)での治療日数(6日)は、対照群(100例)でのデータ(死亡率:25.0%、ICU日数:11日)と比べ良好な傾向を認めるものの、有意差は認められなかった。また、入院期間や咽頭ぬぐい液のウイルスRNA量の推移についても両群で差を認めなかった。一方、嘔気、嘔吐、下痢等の有害事象は、実薬群で多い傾向を認めた。
- コメント:SARS-CoV-2は二つのプロテアーゼをもつが、構造はHIV-1のそれとは異なっており、プロテアーゼ阻害剤として効く可能性は低い。有効性を示す論文は現時点では存在しない。2020年7月4日にWHOはWHO主導で世界17か国で実施中のSolidarity試験においてカレトラ投与のarmを中止すると発表した。
- https://www.who.int/news-room/detail/04-07-2020-who-discontinues-hydroxychloroquine-and-lopinavir-ritonavir-treatment-arms-for-covid-19
プラケニル(ヒドロキシクロロキン:HCQ)
2020年6月15日米国FDAは、クロロキンとハイドロキシクロロキンの緊急使用許可を取り消した。
その理由はCOVID-19に対する有効性が確認できない一方で、重篤な循環器系への有害事象などが報告されたためである(https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and)。
また、HCQとアジスロマイシン併用COVID-19患者におけるQT延長の報告が散見され、潜在的な心毒性が懸念されることから、NIHのCOVID-19治療ガイドラインでは、臨床試験以外でのHCQとアジスロマイシンの併用は推奨しないと記載されている(https://covid19treatmentguidelines.nih.gov/)。
HCQは、マラリアやSLE等の治療薬としてFDA の承認を得ている。作用機序の詳細はわかっていない。2020年2月4日に中国科学院武漢ウイルス研究所のWang等がCell Researchに、HCQがin vitroでSARS-CoV-2の複製を抑えるデータを発表したことから、治療候補役として脚光を浴びることになる。現在までにCOVID-19に対しては多くの試験が行われ、論文も発表されているが、現時点でCOVID-19に対する臨床的有効性を示すエビデンスは現時点では存在しない。
- ⑨ Zhaowei Chen, et al. doi: https://doi.org/10.1101/2020.03.22.20040758.
- ” Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial.” (https://www.medrxiv.org/content/10.1101/2020.03.22.20040758v2.)
- まとめ:中国で実施された62例のCOVID-19患者対象の無作為化臨床試験の結果が未査読論文として報告された。対照群と比べ、HCQ群(200 mg 1日2回×5日間)投与群は、熱や咳嗽の改善が約1日早く、胸部CTで改善を認めた被験者の割合は、対照群(54.8%)と比べHCQ群(80.6%)で高い傾向を認めた。疾患の増悪を認めた被験者は、対照群13%に対し、HCQ群では認めなかった。
- コメント:この論文もmedRxivに公開されている未査読のプレプリントである。
- ⑩ Jun Chen, et.al. Zhejiang Da Xue Xue Bao Yi Xue Ban.2020 May 25;49 (2):215-219. doi: 10.3785/j.issn.1008-9292.2020.03.03.
- “A Pilot Study of Hydroxychloroquine in Treatment of Patients With Moderate COVID-19.” (http://www.zjujournals.com/med/EN/10.3785/j.issn.1008-9292.2020.03.03.)
- まとめ:対照群(93.5%)とHCQ群(200 mg 1日2回×5日間;86.7%)との間で、主要評価項目である7日後の鼻咽頭検体のCOVID-19核酸陰性率は、有意差を認めなかった。
- ⑪ Gautret P, et al. Int J Antimicrob Agents 2020 Mar 20; 105949. doi: 10.1016/j.ijantimicag.2020.105949.
- “Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial.” (https://www.ncbi.nlm.nih.gov/pubmed/32205204)
- まとめ:計26例にHCQ(200 mg 1日3回×10日間)が投与され、うち6例(死亡:1例、ICUへの移動:3例、嘔気による薬剤中断:1例、退院希望:1例)は6日時の検体が採取できず、解析から除外された。解析対象集団における6日時の鼻咽頭検体のCOVID-19核酸陰性率は、対照群(12.5%:2/16例)と比べて、HCQ群(70.0%:14/20例)群で高かった。また、HCQ投与例のうち、アジスロマイシンを併用した6例では6日時に全例陰性化が確認された。
- ⑫ Molina JM, et al. Med Mal Infect. 2020 Jun; 50(4):384. doi: 10.1016/j.medmal.2020.03.006.
- “No evidence of rapid antiviral clearance or clinical benefit with the combination of hydroxychloroquine andazithromycin in patients with severe COVID-19 infection.” (https://www.ncbi.nlm.nih.gov/pubmed/32240719)
- まとめ:先のGautret等の発表に対する反証論文。Molina等はGautret等と同用量でHCQとアジスロマイシンを11名の患者に投与。投与後5日以内に1名死亡、2名がICU、1名がQT延長*で投与中止となった。10名が鼻咽頭スワブのPCR検査を繰り返し行なったが、投与後5-6日の時点でも8/10症例が検査陽性であった。HCQの強い抗ウイルス効果と臨床上の有益性はないと結論。
- ⑬ Tang W, et.al. BMJ. 2020 May 14; 369:m1849. doi: 10.1136/bmj.m1849.
- “Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial.” (https://www.ncbi.nlm.nih.gov/pubmed/32205204)
- まとめ:軽症~中等症COVID-19を主な対象とし、標準治療(SoC)併用下でのHCQ(1200 mg×3日投与後、800 mg×14日間[重症例は21日間])の有効性および安全性を検証する多施設共同非盲検無作為化試験の結果が中国より報告された。28日時までのウイルス陰転化率[95%信頼区間]は、SoC+HCQ群(75例)85.4%[73.8, 93.8]、SoC群(75例)81.3%[71.2, 89.6]であり、両群間の差[95%信頼区間]は4.1%[-10.3, 18.5]であった。安全性解析対象集団における有害事象は、HCQ投与例で30%(21/70例)、非投与例で9%(7/80例)に認められ、HCQ投与例における最も多い有害事象は下痢であった。
- ⑭ Mahévas M, st.al. BMJ. 2020 May 14; 369:m1844. doi: 10.1136/bmj.m1844.
- “Clinical Efficacy of Hydroxychloroquine in Patients With covid-19 Pneumonia Who Require Oxygen: Observational Comparative Study Using Routine Care Data.” (https://www.ncbi.nlm.nih.gov/pubmed/32409486)
- まとめ:酸素補給を要するCOVID-19肺炎による入院患者181例を対象に、HCQ(600 mg/日)投与群(84例)と対照群(標準治療のみ実施:89例)に無作為割付し比較する前向観察研究の結果がフランスから発表された。主要評価項目である、各群におけるICU移送を要さない21日時生存率及び加重ハザード比[95%信頼区間]は、HCQ群76%、対照群75%、0.9[0.4、2.1]であった。21日時におけるその他の有効性指標のHCQ群及び対照群の被験者割合(加重ハザード比[95%信頼区間])は、全生存率89%及び91%(1.2[0.4, 3.3])、ARDSを来たさない生存率69%及び74%(1.3[0.7, 2.6])、酸素補給離脱率82%及び76%(1.1[0.9, 1.3])であった。HCQの10%(8/80例)に、治療中止に至った心電図上の変化を認めた。
- ⑮ Geleris J, et.al. N Engl J Med. 2020 May 7:NEJMoa2012410. doi: 10.1056/NEJMoa2012410.
- “Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19.” (https://www.ncbi.nlm.nih.gov/pubmed/32379955)
- まとめ:2020年3/7~4/8まで、ニューヨーク市コロンビア大学アービング医療センターに入院したCOVID-19連続症例1,376例(ベースラインの救急外来受診24時間以内に挿管、死亡または退院した70例を除く)を対象に、HCQ投与の有無による挿管又は死亡との関連を観察研究で検討した。HCQ投与例の32.3%(262/811例)、非投与例の14.9%(84/565例)で、イベント(挿管又は死亡)が発生し、傾向スコアに基づく確率の逆数で重み付けした多変量 Cox モデルを用いた転帰の比較では、HCQ投与の有無による有意な関連は認められなかった(ハザード比[95%信頼区間]:1.04[0.82, 1.32])。
- ⑯ Mehra MR, et.al. Lancet. 2020 May 22; S0140-6736(20)31180-6. doi: 10.1016/S0140-6736(20)31180-6.
- “Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis.” (https://www.ncbi.nlm.nih.gov/pubmed/32450107)
- まとめ:大規模な国際COVID-19患者登録データを利用して、クロロキン(CQ)単剤、CQ+マクロライド、HCQ単剤、HCQ+マクロライドのいずれかの治療を開始された患者と、CQ//HCQ/マクロライド系の薬剤非投与の患者を対照として抽出し、死亡率減少効果や心室性不整脈のリスクに関して比較した。
- 2019年12月20日~20年4月14日までに、計671の参加病院に入院したCOVID-19患者計98,262例中組み入れ条件に該当する患者は計96,032例であり、治療群14,888例(CQ群1868例、CQ+マクロライド群3783例、HCQ群3016例、HCQ+マクロライド群6221例)、対照群81,144例であった。登録患者のうち、11.1%(10,698/96,032例)が死亡した。
- 複数の交絡因子を踏まえて解析した結果、対照群の死亡率9.3%に対し、治療群の死亡率及びハザード比(HR)[95%信頼区間]は、CQ群16.4%(1.365[1.218, 1.531])、CQ+マクロライド群22.2%(1.368[1.273, 1.469])、HCQ群18.0%(1.335[1.223, 1.457])、HCQ+マクロライド群23.8%(1.447[1.368, 1.469])であり、いずれもHCQ投与群において有意な死亡率の上昇が認められた。また、心室性不整脈の発生頻度は、対照群0.3%に対し、CQ群4.3%(HR3.561[2.760, 4.596])、CQ+マクロライド群6.5%(HR4.011[3.344, 4.812])、HCQ群6.1%(HR2.369[1.935, 2.900])、HCQ+マクロライド群8.1%(HR5.106[4.106, 5.983])であり、治療群で高い傾向が認められた。この試験の結果から、HCQの安全性に懸念が生じたため、WHOは世界17か国で実施中のSolidarity試験を一時中断し、2020年7月6日に最終的に中止を発表した(https://www.who.int/news-room/detail/04-07-2020-who-discontinues-hydroxychloroquine-and-lopinavir-ritonavir-treatment-arms-for-covid-19)。
- コメント:本論文に対して、2020年5月28日、多数の科学者が連名で、研究方法と利用データの整合性に懸念を表明する公開質問状を提出し、Lancetは6月2日、この研究に「重大な疑問」が持たれていることを読者に知らせるため、「懸念の表明(expression of concern)」を発表した。データソースを提供したSurgisphere社に対しデータの開示を求めたが、同社は「様々な政府、国、病院とのデータ共有契約のため、データ共有はできない」と回答し、データ開示を拒否した。このことからデータの信憑性が保たれず再検証は困難であるとのことで、著者4名中3名が論文撤回に同意し(撤回に同意しなかったのは、このサージスフィア社の創業者で、論文の共著者に名を連ねていたSapan Desai氏)、6月5日、本論文は取り下げられた。
フサン(ナファモスタット)
セリンプロテアーゼ阻害剤であり、COVID-19の阻害作用としてウイルスが標的細胞に侵入するときの膜融合を阻害すると報告されている。
in vitroで抗ウイルス効果の報告はあるが、RCT等の公表文献は現時点で公開されていない。フサン、オルベスコを投与された患者の症例報告は下記のとおりである。
- ⑰ Yamamoto M et al., Viruses 2020 Jun 10;12(6):E629. doi: 10.3390/v12060629
- “The Anticoagulant Nafamostat Potently Inhibits SARS-CoV-2 S Protein-Mediated Fusion in a Cell Fusion Assay System and Viral Infection In Vitro in a Cell-Type-Dependent Manner” (https://www.mdpi.com/1999-4915/12/6/629)
- まとめ:Disseminated intravenous coagulation (DIC)治療薬であるnafamostat mesylateが、Transmembrane Serine Protease 2 (TMPRSS2) を阻害することで、SARS-CoV-2の膜融合を抑えることをin vitroの実験系で明らかにした。EC50は使用する細胞種や実験条件により変わり、Calu-3細胞をあらかじめnafamostatで処置をしてからウイルスを添加した場合は、6.8-11,5nM nM、 事前に処理をしない場合は3.16n M、VeroE6/TMPRSS2 細胞では 事前処理では 31.6 µMに対して事前処置なしでは>100µM であった。本論文ではcamostat mesylateの評価も行われているが、nafamostat mesyalateの約10分の1の阻害活性であった。
- ⑱ Jang S, et.al. Int J Infect Dis. 2020 May 26: S1201-9712(20)30379-9. doi: 10.1016/j.ijid.2020.05.072.
- “Three cases of treatment with Nafamostat in elderly patients with COVID-19 pneumonia who need oxygen therapy.” (https://www.ncbi.nlm.nih.gov/pubmed/32470602)
- まとめ:ナファモスタットとカモスタットの投与により肺炎が改善した3例の高齢者症例の報告である。2例はHCQ+LPV/r治療、1例はLPV/r治療を受けていたが、増悪したためにナファモスタットの投与を受けたところ症状および検査値の改善が認められた。
- ⑲ Kent Doi , et.al. Crit Care.2020 Jul 3;24(1):392. doi: 10.1186/s13054-020-03078-z.
- “Nafamostat Mesylate Treatment in Combination With Favipiravir for Patients Critically Ill With Covid-19: A Case Series” (https://www.ncbi.nlm.nih.gov/pubmed/32620147)
- まとめ:重篤COVID-19患者11例に対して、ナファモスタットとファビピラビルの併用療法を行ったケースシリーズ報告が東京大学から発表された。死亡は、人工呼吸器使用中の1例に認められたが、他10例については症状の改善を認め、観察期間中に7例が退院された。また、治療開始時にECMOや人工呼吸器管理を要した8例の患者のうち、死亡1例を除く全例が離脱可能となった。
- コメント:コントロール群のない少数例の症例報告である。現在、ファビピラビル使用下にてナファモスタットの併用効果について検証する特定臨床研究が実施中であり、結果が待たれる。
オルベスコ(シクレソニド)
- ⑳ Iwabuchi K, et.al. J Infect Chemother. 2020 Jun; 26(6):625-632. doi: 10.1016/j.jiac.2020.04.007.
- “Therapeutic potential of ciclesonide inahalation for COVID-19 pneumonia: Report of three cases.” (https://www.ncbi.nlm.nih.gov/pubmed/32362440)
- まとめ:シクレソニドの吸入で改善した3症例の報告である。著者らがシクレソニドを投与した医学的根拠はbioRxivに2020年3月12日付で公開されたin vitroのデータによる(Matsushima et al. bioRxiv 2020 12 March doi.org/10.1101/2020.03.11.987016)。
- コメント:コントロール群のない少数例の症例報告である。bioRxivは査読のないプレプリントである。現在わが国でランダム化比較試験(RACCO試験:jRCTs031190269)が進行中である。
副腎皮質ステロイドの全身投与
- ㉑ Peter Horby, RECOVERY Collaborative Group, et.al. doi: https://doi.org/10.1101/2020.06.22.20137273
- “Effect of Dexamethasone in Hospitalized Patients with COVID-19: Preliminary Report.” (https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1)
- まとめ:イギリスで実施中の非盲検アダプティブプラットホームランダム化比較試験(Recovery試験:NCT04381936)のPreliminary Reportが未査読雑誌に発表された。2104例の患者がデキサメタゾン群(6 mg/日[経口又は静脈内投与]最大10日間)に割付けられ、標準治療を受けた4321例を対照群として比較した。主要評価項目である28日後の死亡率は、デキサメタゾン群21.6%(454/2104例)、対照群24.6%(1065/2104例)であった(年齢調整率比[95%信頼区間]:0.83[0.74, 0.92]; p<0.001)。死亡率及び年齢調整率比は、無作為化時の酸素療法の状態により異なり、侵襲的酸素療法を受けていた患者では、デキサメタゾン群29.0%、対照群40.7%(0.65[0.51, 0.82]; p<0.001)、非侵襲的酸素療法を受けていた患者では、デキサメタゾン群21.5%、対照群25.0%(0.80[0.70, 0.92]; p=0.0002)、酸素療法を受けていなかった患者では、デキサメタゾン群17.0%、対照群13.2%(1.22[0.93, 1.61]; p=0.14)であった。侵襲的酸素療法下又は非侵襲的酸素療法下の患者では、デキサメタゾン投与により死亡率を各々1/3及び1/5に低下させたが、酸素非投与下の患者については治療効果を認めなかった。
- コメント:未査読雑誌にプレプリントとして発表。充分なデータの吟味が必要であるが、デキサメタゾンの有効性について更なる検証が求められる結果である。
- ㉒ Wu C, et.al. JAMA Intern Med. 2020 Mar 13:e200994. doi: 10.1001/jamainternmed.2020.0994.
- “Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China.” (https://www.ncbi.nlm.nih.gov/pubmed/32167524)
- まとめ:武漢市のCOVID-19患者201例の後方視的研究の中で、ARDSをきたした患者において、メチルプレドニゾロンの投与は死亡率を低下させた (ハザード比[95%信頼区間]:0.38[0.20, 0.72])。
抗IL-6抗体;ケブザラ(サリルマブ)、アクテムラ(トシリズマブ)
サリルマブについては、現在企業治験が進行中だが、第Ⅱ/Ⅲ相臨床試験(NCT04315298)の中間解析の結果がプレスリリースされた。
- ㉓ 第Ⅱ/Ⅲ相臨床試験(NCT04315298)の中間解析の結果
- まとめ:本試験では、457例が組み入れられ、145例がサリルマブ400 mg、136例がサリルマブ200 mg、136例がプラセボの投与を受けた。死亡率は、200 mg群36%、400 mg群23%、プラセボ群27%であったが、重篤例226例(全体の49%)に限定した場合の死亡率は、各々46%、28%及び55%であった。この結果を受け、独立データモニタリング員会は、低用量(200 mg)群のへの患者の組み入れの中止と、対象を重篤症例に限定することを勧告した(https://investor.regeneron.com/node/23571/pdf)。
トシリズマブについても、現在国内、海外で企業治験等が実施中である。表中には国内施設が参加している試験の他、海外で実施中のプラセボを対照とした企業治験を選択して掲載したが、各国でアカデミア主体の比較試験が多数実施されている。文献では、下記のようなケースシリーズ報告が散見される。
- ㉔ Xu X, et.al. Proc Natl Acad Sci U S A. 2020 May 19;117(20):10970-10975. doi: 10.1073/pnas.2005615117.
- “Effective treatment of severe COVID-19 patients with tocilizumab.” (https://www.ncbi.nlm.nih.gov/pubmed/32350134)
- まとめ:重症または重篤な肺炎患者21例に対して、標準治療(ロピナビル、メチルプレドニゾロン)併用下にトシリズマブ(4~8 mg/kg、2回まで可)を投与した中国の2施設で実施された後ろ向き観察研究の報告では、全例で体温の正常化が認められ、19例で胸部CTの陰影改善、15例で酸素需要量の低下が認められた。安全性について、随伴する感染はなく、肺炎の悪化や死亡例は認められなかった。
- ㉕ Toniati P, et.al. Autoimmun Rev. 2020 May 3:102568. doi: 10.1016/j.autrev.2020.102568.
- “Tocilizumab for the Treatment of Severe COVID-19 Pneumonia With Hyperinflammatory Syndrome and Acute Respiratory Failure: A Single Center Study of 100 Patients in Brescia, Italy.” (https://www.ncbi.nlm.nih.gov/pubmed/32376398)
- まとめ:標準治療併用下でトシリズマブ(8 mg/kg、2~3回投与)を投与された重症COVID-19肺炎100例の臨床経過が、イタリアから報告された。ICU外で治療された57例のうち、65%(37/57例)が回復又は非侵襲的酸素管理の中断、12%(7/57例)が非侵襲的酸素管理の継続、23%(13/57例)が悪化した(10例死亡、3例ICU入室)。ICUで管理された43例のうち、74%(32/43例)が回復、2%(1/43例)が不変、24%(10/43例)が死亡された。10日時点で、77%(77/100例)で呼吸機能の改善が認められ、うち61例では胸部画像の改善を認め、15例は退院された。一方、呼吸状態が悪化した23例のうち、20例が死亡した。
JAK阻害薬:オルミエント(バリシチニブ)
各種JAK阻害薬の臨床試験が実施されている。国内で実施中のJAKを用いた臨床試験は、現時点ではACTT-1に引き続いて実施中の、レムデシビル併用下でバリシチニブ投与群と非投与群の比較を検証する国際共同臨床試験(ACTT-2試験)のみである。
- ㉖ Cantini F, et.al. J Infect. 2020 Apr 23:S0163-4453(20)30228-0. doi: 10.1016/j.jinf.2020.04.017.
- “Baricitinib therapy in COVID-19: A pilot study on safety and clinical impact.” (https://www.ncbi.nlm.nih.gov/pubmed/32333918)
- まとめ:入院治療を要する中等度肺炎合併COVID-19患者12例について、カレトラとバリシチニブ(4 mg/日経口投与)併用治療を行い、対照患者として、最初の患者がバリシチニブ投与を開始した日より前に入院し、標準治療(カレトラ250 mg/日、HCQ 400mg/日、2週間経口投与)を受けた中等度のCOVID-19肺炎患者12例と設定し、臨床症状を比較した。バリシチニブ投与例では、対照例と比較し、投与2週以内の呼吸器症状、発熱、酸素化状態や検査値異常の改善傾向が高い傾向が認められた。また、バリシチニブ投与を受けた患者は全例ICU入室を回避でき、2週以内に58%(7/12例)が退院できた。
回復者血漿療法
- ㉗ Ling Li, et al. JAMA June 3, 2020. doi:10.1001/jama.2020.10044
- “Effect of Convalescent Plasma Therapy on Time to Clinical Improvement in Patients With Severe and Life-threatening COVID-19. A Randomized Clinical Trial.” (https://www.ncbi.nlm.nih.gov/pubmed/32492084)
- まとめ:2020年2月14日から4月28日にかけて、中国武漢の医療機関7施設で実施された回復者血漿によるCOVID-19治療のRCTの報告である。対象は「重症:呼吸不全且つ又は低酸素血漿」と「重篤:ショック症状、臓器不全、人工呼吸器装着」のCOVID-19患者であり、200例を回復者血漿+標準治療(CP群)100例と標準治療のみ(SOC群)100名の2群に無作為に割り付ける計画であった。しかしアウトブレイクの終息により試験の継続が困難になり、最終的にCP群52例、SOC群51例の合計103例の登録で打ち止めとなった。有効性の評価は、血漿投与28日後における“退院”もしくは“6ポイント・スケールでの2ポイント以上の改善”症例の比率とされた。その結果、28日の時点での有効性は、CP群51.9%に対しSOC群43,1%(p=0.26)と両群に有意差は認められなかった。しかし疾患重症度による階層別解析では、「重症」ではCP群91.3%に対しSOC群68.2%(p=0.03)と、血漿投与群に有意に高い改善率が認められた。一方「重篤」ではCP群20.7%に対しSOC群24.1%(p=0.83)と両群に有意差は認めなかった。28日の時点での死亡率には両群差は認められなかったが、「重症」ではCP群の死亡者数が0だったのに対し、SOC群では2例の死亡が認められた。さらに24、48、72時間目の時点におけるPCRの陰転率をみるとCP群44.7%、68.1%、87.2%、に対しSOC群15.0%、32.5%、37.5%と回復者血漿投与群において、有意に高い陰転化率が認められた。
- コメント:著者らは回復者血漿投与が「無効」と結論付けているが、階層解析では「重症」患者においてCP群の有効性が認められている。また、PCRの陰転化率は、CP群が有意に高いことから、回復者血漿の投与はSARS-CoV-2の複製を抑制するとともに、臨床的にも有益であると思われる。
以上、多くの既存薬がCOVID-19の治療薬候補として挙げられ、試験が進められているが、先にも書いたようにこれらの薬剤はSARS-CoV-2を狙って作られたものではないため、その有効性は限定的と考えるべきである。
根本的な問題の解決はSARS-CoV-2特定的な治療薬の開発を待つ必要があると思われる。
国立国際医療研究センターでのCOVID-19治療薬開発の取り組み
最後に、国立国際医療研究センターでの新薬開発の取り組みについて紹介したい。
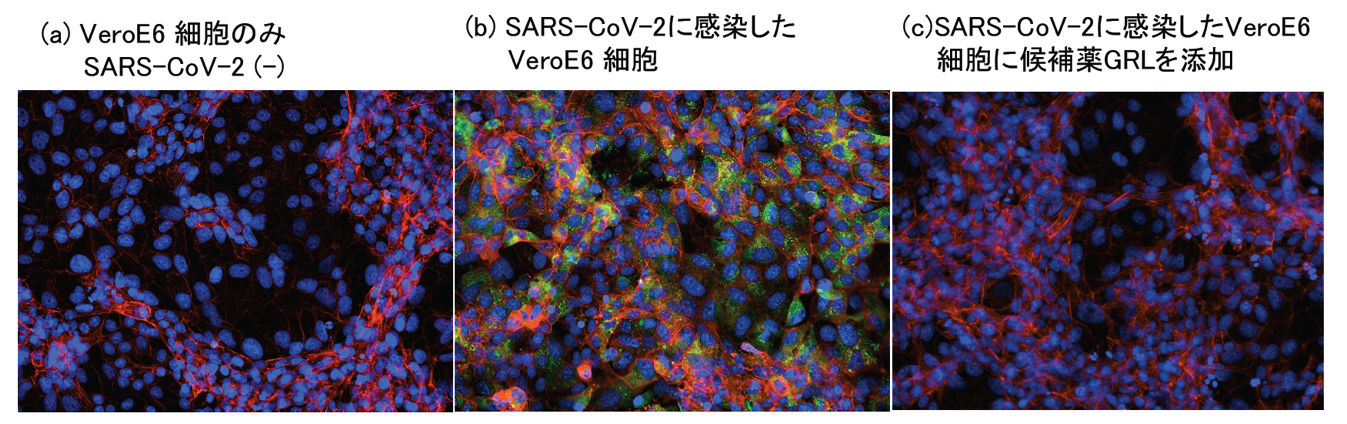
国⽴国際医療研究センター研究所の満屋裕明所長の研究室では、NIH(⽶国⽴衛⽣研究所)のタッグを組んで、COVID-19の治療薬開発に取り組んでいる。COVID-19 の病原体、新型コロナウイルス・SARS-CoV-2 は、薬の開発における標的がHIV の場合と似ている。SARS-CoV-2で狙う標的は3つある。1つ⽬はSARS-CoV-2 が細胞に侵入するステップ、。2つ⽬はSARS-CoV-2 遺伝⼦複製を媒介するウイルス特有のRNA ポリメラーゼ、そして3つ⽬がSARS-CoV-2 の有するプロテアーゼ、特に主要な役割を果たすメインプロテアーゼを狙い撃ちする。このうち、すでに強⼒な抗SARS-CoV-2 効果を確認しているメインプロテアーゼのデータを示す【図2】。
| 図2 |
| COVID-19治療薬候補のGRL化合物はSARS-CoV-2の感染を完全に阻害した |
| メインプロテーゼ阻害剤GRLのSARS-CoV-2効果を蛍光顕微鏡で観察した(青:細胞核、赤:アクチン、緑:SARS-CoV-2抗原: 感染していれば緑が観察される) (c)はSARS-CoV-2を感染させたVeroE6細胞培地にGRL 1μMを添加した結果であるが、(b) GRLを添加していない像と比較すると感染細胞(緑)が全く観察されないこと、つまりSARS-CoV-2の感染が完全に抑えられたことがわかる。また、(c)では (a)同様に正常のVeroE6細胞像が観察される。 |
 |
