COVID-19 パンデミックにおける循環器疾患の管理
| 小川 久雄 | 国立循環器病研究センター理事長 |
| COI: | なし |
- Coronavirus disease 2019 (COVID-19)を引き起こすSevere acute respiratory syndrome coronavirus 2 (SARS-CoV-2)はパンデミックに達した。
- 循環器疾患危険因子を持つ人や明らかに循環器疾患を認める人はCOVID-19に罹患しやすく、罹患すると重症化しやすい。
- COVID-19の患者さんで循環器疾患を発症すると重篤になり死亡率が上昇する。
- SARS-CoV-2 は ヒトのreceptorであるangiotensin-converting enzyme 2 (ACE2)に結合して細胞内に入る。ACE2は肺、心臓、血管に発現し、心血管疾患の病態に重要なrenin angiotensin system (RAS)のキー分子である。
- COVID-19に罹った心血管患者ではACE2の減少やRAS/ACE2システムの異常をきたしAngiotensin II上昇を引き起こし炎症を惹起する。
- 炎症からサイトカインの嵐を引き起こし、免疫システムを活性化する。免疫システムの活性化からプラークの不安定化を招き、急性冠症候群や脳梗塞を発症、また血管炎や心筋炎を引き起こす。
はじめに
中国の武漢市政府が未知の感染症の存在を公表したのが2019年12月31日であったが、それから4ヶ月で世界で400万人が感染し、パンデミックとなり、25万人が死亡する事態となった。国内でも1万7,000名以上が感染し、死亡者も780名を超え、その死亡率は4%を上回る。
SARS-CoV-2によるCOVID-19においては、病態重症化の中心はウイルス性肺炎である。しかし心血管系システムにも重大な影響を及ぼす。まず循環器疾患危険因子を持つ人や明らかな循環器疾患の人はCOVID-19に罹患しやすいという特徴があり、罹患すると重症化しやすいという特徴がある。実際、COVID-19の患者さんで循環器疾患を発症すると重篤になり死亡率が上昇する。
本稿では、COVID-19の循環器合併症や、循環器病患者に対する注意などについて解説する。現時点では、まだパンデミックは進行中でもあり、国内では十分な知見も蓄積されていない状況より、海外の文献を中心に国内の現状も踏まえて述べる。
COVID-19と心血管疾患発症の機序
COVID-19はSARS-CoV-2によって引き起こされる。SARS-CoV-2は細胞のangiotensin-converting enzyme 2 (ACE2)に結合して細胞内に入る[1]。ACE2はAngiotensin II(Ang II)をAng-(1-7)へ、またAng IをAng-(1-9)へ変える酵素であり、心血管保護に働くペプチドである。SARS-CoV-2は主に肺で広がり、SARS-CoV-2感染によりRenin Angiotensin System (RAS)/ACE2 システムは壊れ、重症肺炎を生じる。ACE2は肺のみでなく、心臓や血管にも存在するため、心血管疾患を引き起こす。(RAS)/ACE2 システムは壊れ、ACE2が減少し、Ang IIが増加する。その結果、炎症を引き起こし、さらにはサイトカインストームとなる[2]。また、SARS-CoV-2は心筋や血管内皮細胞に作用して炎症を起こし、心筋炎や冠動脈病変による急性冠症候群、脳血管では脳梗塞、静脈では静脈炎から静脈血栓さらには肺塞栓症を生じる[3]。ACE2 receptorは血管内皮細胞に広く分布するが、剖検所見でもSARS-CoV-2が血管内皮細胞に感染が証明されている[4]【図表1】。
| 図表1 |
| 新型コロナウイルス感染症(COVID-19)での心血管系の関与 – 主要な所見および想定されるメカニズム |
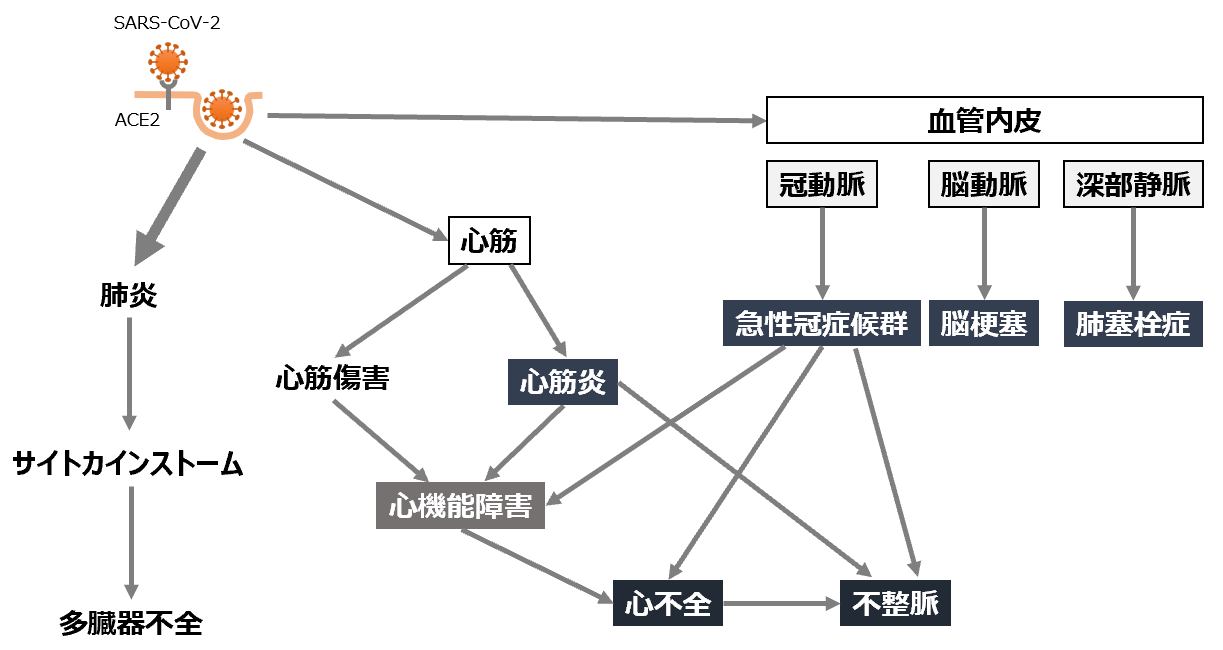 |
| Guzik, TJ. et al. Cardiovasc Res. 2020 doi: 10.1093/cvr/cvaa106. より改変 |
COVID-19と心血管病変
1)COVID-19感染の冠動脈疾患患者の管理
COVID-19感染者における心血管病は多彩で複雑であり、ST上昇を伴う疾患はST-Segment Elevation Myocardial Infraction(STEMI)のみならず、心筋炎、たこつぼ心筋症、冠攣縮性狭心症あるいは原因のはっきりしない心筋障害がある。
適切な個人用防護具personal protection equipment(PPE)と患者のマスキングにより医療従事者の安全を確保することが必要である。
米国心臓病学会から発表された指針では、現時点ではSTEMIに対する治療方針は欧米、本邦のSTEMIのガイドラインに準じてprimary PCIによる血行再建が推奨されている[5]。
Non-ST-Segment Elevation Acute CoNon-ST-Segment Elevation Acute Coronary Syndromesに関してもハイリスク患者には侵襲的治療を優先するが、中等度以下のリスクCoronary computed tomography angiogram/angiographyなどを用いて保存的な治療を優先する。
COVID-19蔓延地域での慢性冠動脈疾患Chronic coronary syndrome(CCS)に対しては薬物療法を最適化し、場合により強化すべきである。可能な限り侵襲的検査は感染軽快後に検討する。
心原性ショックが生じた場合には特に注意を要する。COVID-19蔓延状況においても、ガイドラインに準じ、心原性ショックの対応には迅速な血行再建治療、機械的サポートの導入のため、カテーテル室のスタンバイを行い、初期対応に臨む。
なお、ショック症例では、病歴の確認が不十分となりえる。したがって、常日頃からCOVID-19感染の有無にかかわらず、適切なPPEを要する。とくに挿管、抜管の処置は陰圧部屋かつ麻酔科医による手技が望ましく、カテーテル室管理の点から、カテーテル室での同処置はできるだけ避けるべきである。
2)COVID-19感染者の心筋炎、心不全の管理
COVID-19患者では、心筋トロポニンやCK-MB上昇により定義される心筋傷害(Myocardial injury)が7.2-37.5%で認められると報告されている。その一部には、心電図変化や心臓超音波検査での収縮能低下・心嚢液貯留などを認め、心筋炎(Myocarditis)を来たしていると考えられている[6]。
COVID-19関連心筋炎の報告の多くは、バイオマーカーや画像所見から臨床的に心筋炎と診断しているものが多数であるため、心筋生検などで病理学的に心筋炎と診断される症例の頻度は明らかになっていない。しかし、心筋生検や心臓MRI検査で心筋炎像を認めた症例や、著明な心機能低下や心原性ショックを呈した劇症型心筋炎の症例も報告されている。
COVID-19関連心筋炎の治療については、明確な治療指針は示されておらず、通常のウイルス性心筋炎に準じた治療が行われる。ステロイド、免疫グロブリン製剤、IL-6阻害薬などが有効であったとする症例報告もあるが、その有効性は確立していない。
また心筋炎以外にも、COVID-19に関連した心不全の原因として、たこつぼ型心筋症(ストレス心筋症)・急性心筋梗塞・肺塞栓症なども報告されている。
基礎心疾患を有する慢性心不全例では、COVID-19感染を契機とした心不全増悪を認める場合もある。COVID-19に関連した心不全に対しては、COVID-19非感染例と同様の心不全治療を行うことが推奨されている。すなわち、軽症から中等症の心不全を発症した場合、利尿薬等の使用で心不全加療を行う。アンギオテンシン変換酵素(ACE)阻害薬やアンギオテンシン受容体拮抗薬(ARB)の内服は、COVID-19感染やその重症度との関連は認めなかったとしており、現状では薬剤中断による心不全増悪も懸念されることから、これらの薬剤は中断せず継続すべきである[7]。
心原性ショックとなった場合には強心薬の使用に加え、機械的補助循環の使用も検討される。肺炎による呼吸不全が改善したのちにも心原性ショックは起こりうるとされており、COVID-19患者の急激な状態の悪化は常に心原性ショックを鑑別に入れる必要がある。
3)COVID感染患者の不整脈管理
COVID-19患者における不整脈関連の報告も徐々に増加している。中国そして欧米ではパンデミックに伴う患者数の爆発的増加に伴い多くの重症例が出現し、ICUでの厳重な管理が必要となったが、このような重症患者群では不整脈合併も問題の一つとなっている。特に欧米からの報告として多いのがChloroquineもしくはChloroquine/Azithromycin併用に関連したQT延長とTdP (torsades de pointes、倒錯型心室頻拍)である。今後本邦でもChloroquineの使用頻度の増加が予想され、その他の抗ウイルス薬も含めて投与時には注意が必要である[8]。
COVID-19感染に特異的な不整脈出現の報告は未だ明らかではなく、現状では心電図は特にQT間隔を確認し、電解質補正、解熱など一般的対応を慎重に行い、元々心疾患を合併する例では既存疾患の状況に応じ通常どおり対応することが肝要である[9]。
4)COVID-19と静脈血栓塞栓症
COVID-19は過剰な炎症反応、低酸素血症、不動、全身性の凝固活性化(DIC)のために血栓性合併症を引き起こすことが報告されている。中国からの報告ではD-dimerの上昇が42%に認められ、D-dimerの上昇と院内死亡との関連が示唆されている[10]。オランダからの多施設報告でCOVID-19による肺炎でICUに入院した重症患者184例の検討では、合併症としては静脈血栓塞栓症(Venous thromboembolism: VTE)が最も多く27%であった(11)。血栓合併症の中では肺血栓塞栓症が25例と最も多かった。
これらの結果よりCOVID-19肺炎重症例においては静脈血栓塞栓症、特に肺塞栓症の発症に注意が必要であり、重症例においてはD-dimerの上昇を指標に、心エコーでの右心負荷、肺高血圧症の有無に注意を払うべきである。ICU入室する重症COVID-19肺炎患者においてはVTEの発症を念頭において下肢エコー、D-dimer等でのスクリーニングが必須であり、弾性ストッキング着用、予防的抗凝固療法等が検討されるべきである。特に緊急事態宣言が出された日本では、今後発症に注意すべきである。
5)COVID-19と川崎病類似症状
2020年5月6日に英国ロンドンのSouth Thames Retrieval ServiceからLancetに8例のHyperinflammatory shock重症小児患者の報告があった[12]。8例の中には川崎病類似症状(発疹、眼球結膜の充血、浮腫、1例は冠動脈瘤)を伴う患者がいた。また5月8日に米国ニューヨークからは衛生局の声明とクオモ知事から73例の川崎病類似症状や毒素性ショック症候群が疑われる症状を有する患者が確認されたと報告された。ただし現時点ではアジアからはそのような報告はない。
元々、川崎病の発症にコロナウイルス感染が関与する可能性は指摘されている。COVID-19でも川崎病は起こりうるが、従来のコロナウイルスと比較してより川崎病発症に関与しやすいか、より川崎病の重症化に関与しやすいかについては結論できない。
6)Extracorporeal membrane oxygenation (ECMO)
ECMOにはVenous-arterial (V-A)ECMO、Venous-Venous (V-V) ECMOがあり、一般的にそれぞれ心原性ショック、重症呼吸不全に対する治療である。COVID-19の呼吸不全に対しては人工呼吸器でコントロールできない場合にはV-V ECMOが適応となる【図表2】【図表3】。
| 図表2 |
| V-V ECMO(静脈脱血⇒静脈送血) |
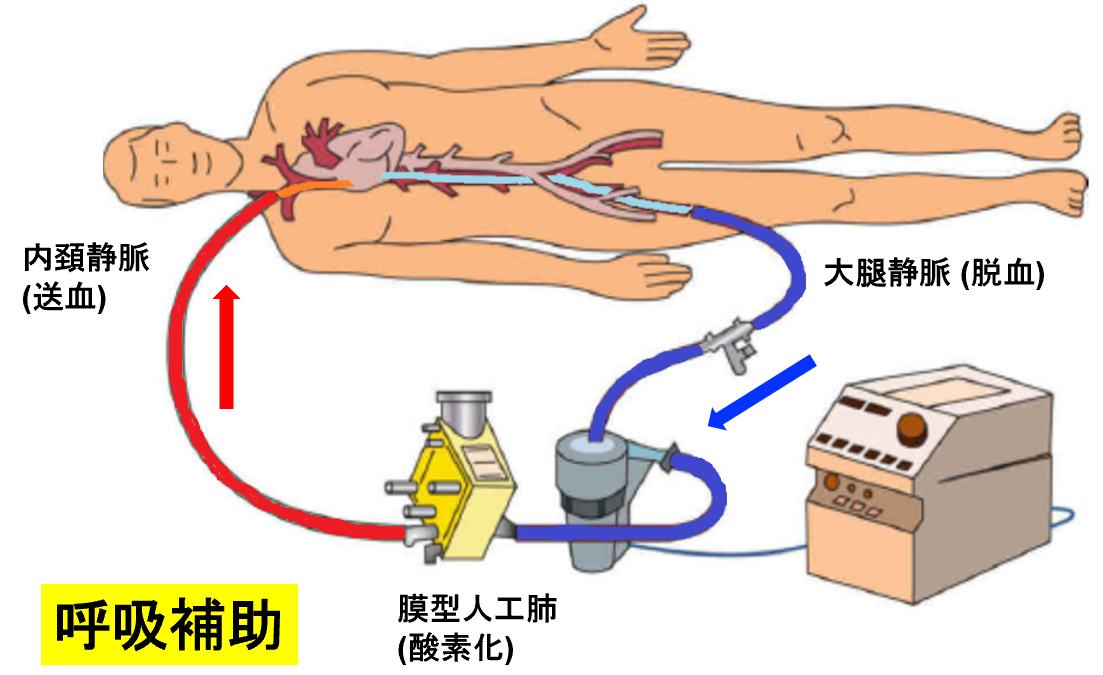 |
| 図表3 |
| V-A ECMO(静脈脱血⇒動脈送血) |
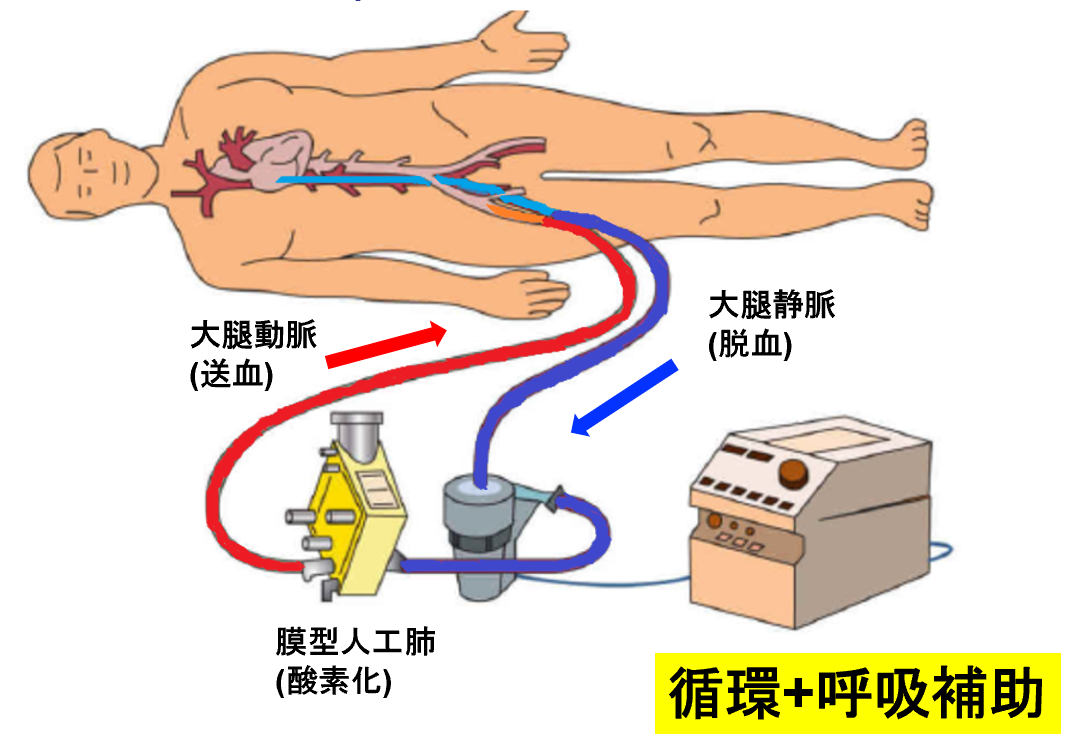 |
COVID-19感染に伴う肺炎から第11病日に劇症型心筋炎を合併しV-A ECMOが導入された1例63歳の中国深圳市からの報告がある[13]。心原性ショックに対するV-A ECMOの治療戦略については今後さらなる症例の積み重ねが必要と思われる。
The Extracorporeal Life Support Organization (ELSO)は大量輸液や血管作動薬に反応しない臓器還流不全を伴う低血圧のような症例においてV-A ECMOを推奨している。COVID-19患者は炎症促進性かつ血栓形成傾向状態であり、凝固異常が5分の1の症例に報告されており、ECMO管理上の注意点として、凝固関連モニタリングを十分に行い、血栓、出血ともに合併症のリスクに留意することが求められる。
日本COVID-19対策ECMOnet、日本集中治療医学会専門医認定施設、日本救急医学会救急科専門医指定施設を中心に日本全国570以上の施設が参加している横断的ICU情報探索システム(CRoss Icu Searchable Information System, 略称CRISIS)がある。日本集中治療学会によると2020年5月16日において適応など詳細は不明であるものの、人工呼吸器を着けた225名のうち182名(81%)が回復して取り外せた。またECMOを使用した106名については、78名(74%)が機器が不要になるまで回復した。日本の成績からECMOは期待される治療手段であることに間違いはないが、一方でCOVID-19の蔓延状況、医療資源の状態、患者のリスクからその適応については医療チームでの検討の上でなされることが望ましい。
7)COVID-19と脳卒中
COVID-19 では凝固異常や⾎栓症の合併頻度が⾼いことが知られ、そのリスクは重症例ほど増加する。脳も例外ではなく,COVID-19入院患者の214例中6例(2.8%)に脳卒中(5例に脳梗塞,1例に脳出血)が合併したと報告され,特に重症例における合併が5.7 %と高かった[14]。感染徴候が出現してから約10–12日を経て,肺病変の拡大とともに脳卒中の合併が見られ,COVID-19の臨床症状の悪化が脳卒中に起因する可能性を常に念頭に置く必要がある。さらに,50歳未満のCOVID-19患者5名の若年脳梗塞例が報告され,若年者でも脳梗塞合併に留意しなければならない。これら5症例は,内頚動脈,中大脳動脈,後大脳動脈に血栓が認められ,病態に応じて血栓溶解療法,血栓回収療法,抗血栓療法などが行われた[15]。D-dimer上昇例では予防的な抗凝固療法が行われることも考慮しなければならない。COVID-19パンデミック下では,受診を躊躇して脳卒中の発症―治療開始時間が遅延しがちであるが,脳卒中診療は時間との闘いであり,パンデミック下でも引き続き内科緊急症としての適切な対応が必要である。
8)新型コロナウイルス感染症(COVID-19)の流行で、患者、医療従事者、医療機関が留意すべき点
心血管疾患の既往がある患者では、患者および医療従事者の双方にてウイルスの伝播を防ぐうえで、電話や情報通信機器を用いた診療を活用することは有用である。また、同様の理由でセルフモニタリング、遠隔モニタリングについてもこれまで以上に重要となる。心血管疾患危険因子をもつ患者での受診・加療を妨げるべきではないが、COVID-19の封じ込めの上で、受診や加療の優先度を考えるべきかもしれない。心血管既往のある患者ではCOVID-19に感染した場合に重症化しやすい可能性が指摘されており、マスクの着用などの使用による感染予防はより重要となる。
COVID-19陽性者で心血管既往のある患者では、これらの心血管合併症への注意のほか、病状悪化や急変を想定したより頻回の観察が望ましい。また、普段から循環器治療薬の治療を受けていることから、COVID-19の治療に際しては薬物相互作用や、臓器障害の可能性を慎重に評価すべきである[16]。
医療従事者では、曝露リスクに応じてPPEの適切な使用が必要となる。
また、直接の診療以外でも、プロフェッショナルが集まる機会についても感染予防を考慮されたい。国内外の他の諸学会と同様に、日本循環器学会学術集会では日程を延期したうえでさらに開催形態を変更し、Web開催とした。診療カンファランス、講習、学会等の人が集まる機会を最小限にし、日程の延期や遠隔会議の活用を行っていただきたい。以上を【図表4】にまとめて記載した。
| 図表4 |
| 新型コロナウイルス感染症(COVID-19)の流行で、患者、医療従事者、医療機関が留意すべき点 |
| 新型コロナウイルス感染症(COVID-19)流行下における、既診断の心血管疾患のある患者、心血管疾患のない患者、および医療従事者・医療機関にとって重要となる留意点。 PPE: personal protective equipment(個人防護具) |
 |
| Driggin, E. et al. J Am Coll Cardiol. 2020;75(18):2352–71. より改変[16] |
[引用文献]
- Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Walls AC, Park YJ, Tortorici A, et al. Cell. 2020 April 16; 180:281-292.
- COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome. Hirano T, Murakami M. Immunity. 2020 May 19, 52: in press.
- ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. European Society of Cardiology. 2020 April 21.
- Endothelial cell infection and endotheliitis in COVID-19. Varga Z, Flammer AJ, Steiger P, et al. Lancet. 2020 April 17 Published Online.
- Management of Acute Myocardial Infarction During the COVID-19 Pandemic. A Consensus Statement from the Society for Cardiovascular Angiography and Interventions (SCAI), American College of Cardiology (ACC), and the American College of Emergency Physicians (ACEP). Mahmud E, Dauerman HL, Welt FGP, et al. J Am Coll Cardiol. 2020 April 21.
- Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. Shi S, Qin M, Shen B et al. JAMA Cardiol 2020. [Epub ahead of print]
- Renin-Angiotensin-Aldosterone System Blockers and the Risk of Covid-19. Mancia G, Rea F, Ludergnani M, et al. Renin-Angiotensin-Aldosterone System Blockers and the Risk of Covid-19. N Engl J Med 2020. May1, [Epub ahead of print]
- The Effect of Chloroquine, Hydroxychloroquine and Azithromycin on the Corrected QT Interval in Patients with SARS-CoV-2 Infection. Saleh M, Gabriels J, Chang D, et al. Circulation: Arrhythmia and Electrophysiology. 2020 April 29.
- SARS-CoV-2, COVID-19, and inherited arrhythmia syndromes. Wu CI, Postema PG, Arbelo E, et al. Heart Rhythm. 2020 Mar 31.
- Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Zhou F, Yu T, Du R, et al. Lancet. 2020 March 28 ; 395:1054-1062.
- Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Klok FA, Kruip M, van der Meer NJM, et al. Thromb Res. 2020 April 30.
- Hyperinflammatory shock in children during COVID-19 pandemic. Riphagen S, Gomez X, Gonzalez-Martinez C, et al. Lancet 2020 May 6.
- First case of COVID-19 complicated with fulminant myocarditis: a case report and insights. Zeng JH, Liu YX, Yuan J. Infection. 2020 April 10.
- Neurologic Manifestations of Hospitalized Patients with Coronavirus Disease 2019 in Wuhan, China. Mao L, Jin H, Wang M, et al. JAMA Neurol. American Medical Association; Epub 2020.
- Large-Vessel Stroke as a Presenting Features of Covid-19 in the Young. Oxley TJ, Mocco J, Majidi S, et al. New Engl J Med. 2020 April 28.
- Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the COVID-19 Pandemic. Driggin E, madhavan MV, Bikdeli B, et al. J Am Coll Cardiol. 2020 May 12 ;75:2352-71.
