新型コロナワクチン開発と臨床試験の倫理-ポストコロナへの道標-
| 栗原 千絵子 | 生命倫理政策研究会 共同代表 |
| 齊尾 武郎 | フジ虎ノ門整形外科病院 内科・精神科 |
| COI: | なし |
- 新型コロナウイルス感染症予防ワクチンの開発が世界中で進められ、欧米主導の3つのワクチンが70~90%の有効率を示し「緊急使用承認」を受け、世界各国に供給され、大規模接種が開始されている。これらのワクチンは日本にも本年前半には供給される。
- 中国、ロシアで開発されたワクチンも、緊急使用承認を受け、世界各国への供給・接種が拡大している。
- これらワクチン開発の臨床試験は約2年間で計画されていたが、中間解析の結果を受けて承認された。今後、プラセボ対照による臨床試験を継続する必要がある。
- 副反応に関しては承認後の大規模接種における情報を集積する「データ稼働型対策」が必須である。
- 新型コロナウイルスパンデミックは地球規模の問題であり、終息のためには、地球上のあらゆる地域でワクチンを必要としている人々に届けなければならない。
- ワクチンは「魔法の弾丸」ではなく、パンデミック終息に向けた一つの道標である。感染対策に万全を期し、ポストコロナ社会を展望して、学術分野を超え、患者・市民の参画を得て、協働を継続しなければならない。
新型コロナワクチン承認と臨床科学の
インテグリティ
「緊急使用承認」と供給・接種の動き
新型コロナウイルス感染症(以下「COVID-19」という。)予防ワクチン(以下「新型コロナワクチン」という。)の各国における緊急使用承認(Emergency Use Authorization: EUA。なお各国において制度や呼称の違いはあるが本稿では緊急事態下の例外的な承認を「EUA」又は単に「承認」と記載する。)と、承認取得企業から各国への供給、各国での大規模接種の動きが、2020年暮から2021年初頭にかけて急速に進んでいる。2021年1月6日までに全世界で1,500万回分を超えて接種されたと推測されるが【図表1】(appendix)、これは既に出荷され供給されている量のほんの一部に過ぎない。
| 図表1 |
| 各国における新型コロナワクチン接種回数 |
| 下記出典より使用条件を確認の上転載。 2021年1月6日までに情報を得た新型コロナワクチン接収回数を示す。 1月6日以降も接種は進んでいるので、最新情報は下記出典より参照されたい。 データの出典はweb-site下に表示されており、報道や政府ツイッター発表等の、政府公式資料ではない情報も含む。(関連図表はappendix参照/PDF) |
 |
| Source: Our World in Data. Statistics and Research: Coronavirus (COVID-19) Vaccinations Research and data: Hannah Ritchie, Esteban Ortiz-Ospina, Diana Beltekian, Edouard Mathieu, Joe Hasell, Bobbie Macdonald, Charlie Giattino, and Max Roser Web development: Breck Yunits, Ernst van Woerden, Daniel Gavrilov, Matthieu Bergel, Shahid Ahmad, and Jason Crawford https://ourworldindata.org/covid-vaccinations 2021年1月7日アクセス |
2020年12月中に、欧米企業と研究機関により開発された3つのワクチンが、それぞれ有効率95%(ファイザー社とビオンテック社の共同開発によるmRNAワクチン)[1,2]、94.1%(モデルナ社と米国国立アレルギー感染症研究所の共同開発によるmRNAワクチン)[3,4]、70%(2種類の投与法のうち1種類については90%)(オックスフォード大学とアストラゼネカ社の共同開発によるアデノウイルスベクター・ワクチン)[5]を達成した。米国食品医薬品局(Food and Drug Administration: FDA)[6]が有効性の目安として示していた50%を大きく上回り、通常5~10年かかるとされるワクチン開発が1年未満で実現された。中国・ロシアのワクチンも有効率70~90%を示したとして、査読誌での発表に先行して政府や研究機関から発表され、インドで開発されたワクチンも同国においてEUAを取得した【図表2】(appendix)。
新型コロナウイルスの地球規模のパンデミックを克服するためには、地球上でワクチンへのアクセスが困難な人々にも有効かつ安全なワクチンを届ける必要がある。同時に、大規模検証的臨床試験の完遂前のEUAと世界的な大規模接種という臨床科学の歴史上経験したことのない介入のアウトカムを、注視していかなければならない。
| 図表2 |
| 世界の承認取得した新型コロナワクチン(新規開発品に限る。2021年1月初旬。) |
| (詳細はappendix参照/PDF) |
 |
緊急使用承認とプラセボ対照試験の倫理
次々と新型コロナワクチンが承認され、各国に供給される一方で、これらのワクチンはプラセボ対照によるフォローアップ期間を含め約2年間の計画とされているため、EUAが出された後もプラセボ対照試験を継続すべきであるという世界保健機関(World Health Organization: WHO)諮問委員会の見解が示された[17]。その著者には米国FDA職員やEUAを受けたワクチンの開発研究機関の研究者も含まれる。しかしファイザー、モデルナなどの開発企業は、既に臨床試験参加者にプラセボ群であった場合にもワクチン投与を受けることができる旨を通知している[18]。世界医師会「ヘルシンキ宣言」2000年改訂以来論争の続く「試験終了後のアクセス」の提供について、FDAやグローバル企業は試験終了後医療保健制度の中で利用可能となるまでに時間がかかるため困難だと主張していたのだが、今は企業側が率先して倫理的責務として実行している。これはグローバル企業が臨床試験の南北問題の中で「途上国で行ったプラセボ対照試験の結果開発された製品が高額であるため実施地域の人々がアクセスできない」として批判にさらされてきた苦い経験への反省によるのかもしれない。パンデミック克服に向けた企業の社会的責任の履行とも解釈できる。あるいはまた、各国政府による購入契約を前倒しにして需要を喚起するマーケティング戦略なのかもしれない。
ワクチン開発を1年未満で達成した驚異的なスピードは、米国トランプ政権下の「ワープ・スピード作戦」が約170億ドル(約1兆8千億円)の資金投入のみならずあらゆる手続き的障壁を除去し、第二次世界大戦中の原子爆弾開発計画「マンハッタン計画」にも例えられた産官学の強力な協働体制を導いたことにもよる[19]。欧州諸国・カナダなども大規模なワクチン開発計画に資金投入し、グローバル製薬企業がバイオテクノロジー企業や研究機関とアライアンスを組むなどして、世界中の英知が結集された。
その反面、臨床試験の計画書で事前に規定された中止基準により試験の中止が決定されたのではなく、継続中の試験の中間解析結果を受けて、各国でのEUAと大規模接種が開始されている。これにより、追跡によるデータを得る機会を失ってしまえば、地球規模の科学的損失ともなろう。FDAは2020年6月[6]、10月[20]のガイダンスで、臨床試験参加者にEUA後にワクチンを提供する倫理的責務の判断を開発者に委ねる意向を示している。FDA諮問委員会ではクロスオーバー試験によりすべての参加者にワクチンを提供しつつプラセボとの比較を可能にする案も示されたが、この提案は未だ採用されてはいない[18]。
「市販後」のデータ集積の重要性
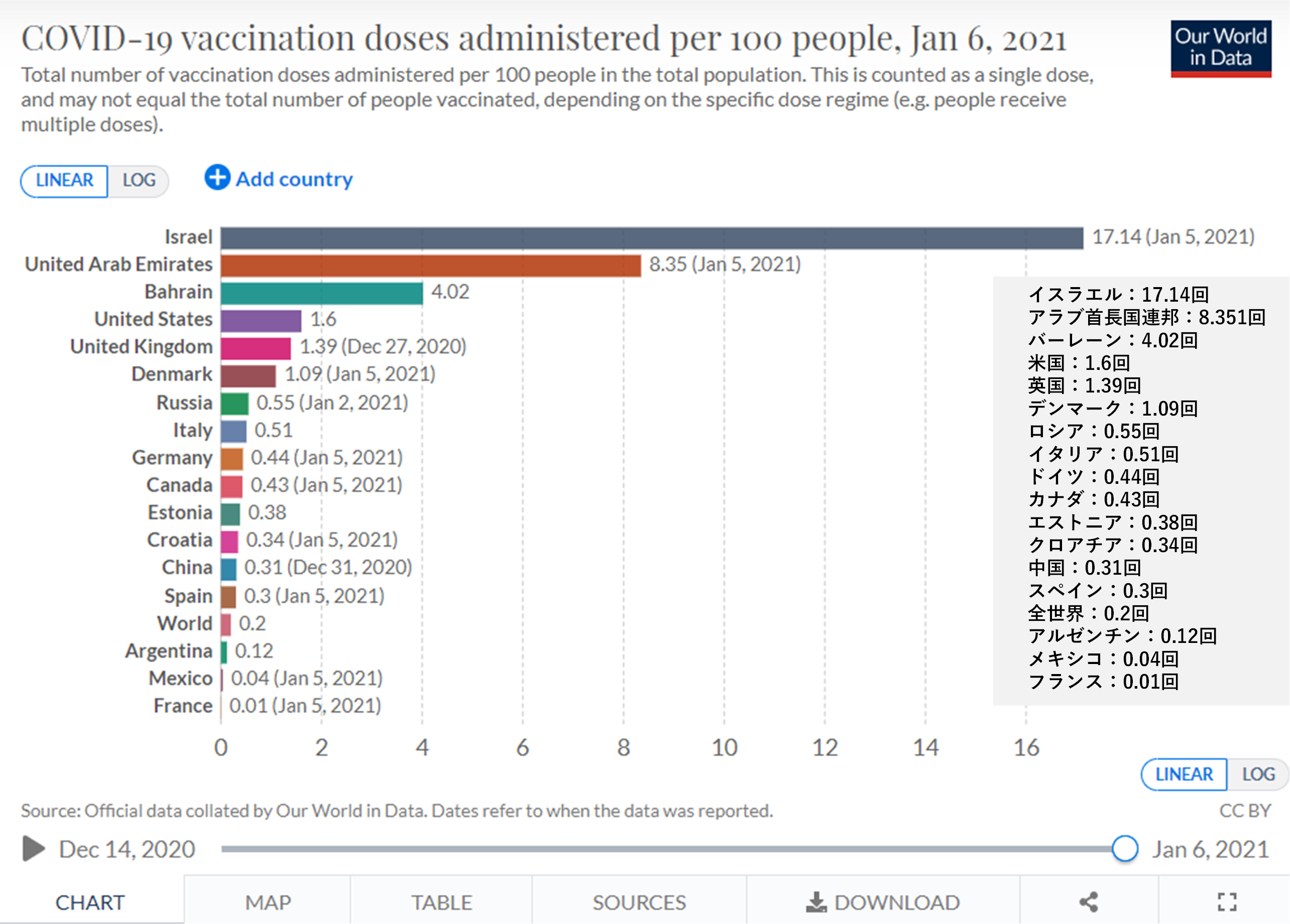
EUAによる接種開始後の有害事象の発生の報告が続いたことから2つのmRNAワクチンについては重篤なアレルギー反応履歴のある者には禁忌とされたが、米国疾病予防管理センター(Center for Disease Control and Prevention: CDC)は既に約190万人の接種における21例の有害事象の発生の個別データを公表している[21]。その他のワクチンも含めて、臨床試験中に稀に発生したがワクチンとの因果関係を認められなかった横断性脊髄炎[5]、ギラン・バレー症候群を示唆する神経症状[12]、EUA後の接種での心不全死[7]、急性免疫性血小板減少症による死亡[8]、などワクチンとの関連性が不明な有害事象についての情報も、今後同様に迅速に集積していかなければならない。各国の接種キャンペーンでは90歳前後の高齢者が接種第1号、第2号としてメディアに登場したが、85歳以上の高齢者のデータは臨床試験ではほとんど得られておらず、基礎疾患のある高齢者の接種後死亡も報告されている[9]。小児、妊婦などの特別な保護を必要とする脆弱な対象者の接種に関する情報の集積も今後求められる。一方、人口あたりの接種数が世界最多のイスラエル【図表1-appendix3参照】では、接種した人口集団において感染率が減少していることを発表[22]、リアルワールド・データによるリスク・ベネフィット評価の事例を示している。
最も重要な課題は、ワクチンにより引き起こされることが危惧されている呼吸器疾患増強(ERD: Enhanced Respiratory Disease)、抗体依存性疾患増強(ADE: Antibody-Dependent Enhancement)であり、再感染率や再感染時の重症度、ワクチンの効果が継続する期間、COVID-19の有病率の低い地域での有効性・安全性、また変異株に対する効果(開発された技術の応用を含む)などについても、今後科学的な知見を得る必要がある。ある地域で集団免疫が獲得されたとしてもワクチンの効果なのか自然経過によるものなのか判然としない反面、ワクチンに起因しない疾患の発生がワクチンによるものと誤って判断される(第1種の過誤)、といった状況はできる限り回避しなければならない。大規模検証的臨床試験の完遂によって得られるはずの科学的インテグリティと、倫理的要請とのバランスの取れた価値判断が、今後各局面で求められてくる。
日本の現状と臨床科学への寄与
欧米主導の3つのワクチンについて、日本政府は2021年中に1億2千万人の国民全員に2回投与を行う分に加えて4千万回分の供給を受けることの合意が各製薬企業との間で成立している。いずれも日本は検証的臨床試験には参加していないが、臨床薬理試験は実施しており、1つのワクチンは2020年12月中に承認申請され、他2つも順次申請され、「特例承認」が得られることになるだろう。これらのワクチンについては既に日本感染症学会ワクチン委員会による有効性・安全性についての解釈に基づく提言文書がまとめられ[23]、厚生労働省から自治体に対する接種計画の説明[24]も実施され、専門家集団の提示する計画に沿って適正かつ着実に段階的な接種が進められることが望まれる。
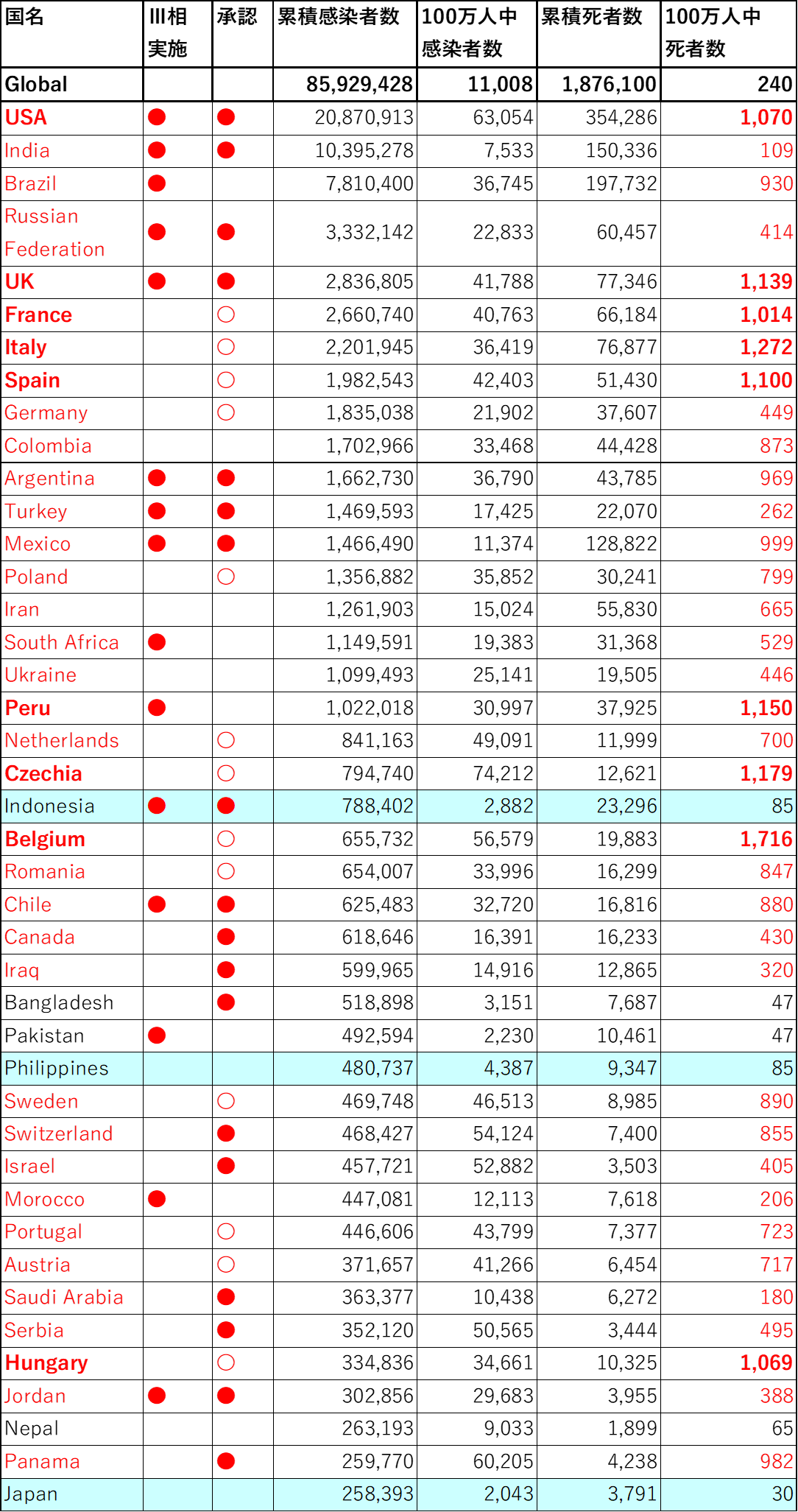
ワクチンの有効性・安全性について生物医学的な民族差は現状では見出されていないが、米国のように1,000人に1人がCOVID-19により死亡している地域と、日本のように3万3,000人に1人の死亡率である地域【図表3-1】とではワクチンの持つ意味は大きく異なる。それでも、ASEAN諸国10か国+日本・中国・韓国・台湾という東・東南アジア文化圏の中で感染者数が第3位【図表3-2】(appendix)の日本にとって、今後のワクチンの科学的評価に貢献するために担うべき役割がある。
| 図表3-1 |
| 累積感染者数とワクチンⅢ相実施・承認及び死亡率の状況 |
| WHOの下記サイトより2021年1月7日ダウンロードし著者にて作表。 累積感染者数の多い順に並べ、Ⅲ相試験の実施・ワクチン承認の状況と対比した。EU加盟国は各国について調査していないがEUとしての承認に基づき企業からの供給を得る契約により各国に供給されるため〇印とした。 ・赤字:100万人中死者数が100人を超える ・赤太字:同1,000人を超える ・水色背景:ASEAN+日本・中国・韓国・台湾(次頁に続く) |
 |
| WHO Coronavirus Disease (COVID-19) Dashboard https://covid19.who.int/ |
| 図表3-2 |
| 累積感染者数とワクチンⅢ相実施・承認及び死亡率の状況(ASEAN+日本・中国・韓国・台湾) |
| WHOの下記サイトより2021年1月7日ダウンロードし著者にて作表。 前頁からの連続したテーブルより、ASEAN+日本・中国・韓国・台湾のみを抜粋。 前頁で日本の世界全体の中の位置付けを明らかにするとともに、ASEAN+日本・中国・韓国・台湾の中における位置づけを明らかにすることを意図した。 (詳細はappendix参照/PDF) ※台湾はWHOサイトにデータが無いため日本の厚生労働省のデータで補った。 *厚生労働省(日本)より(引用元:台湾当局) |
 |
| WHO Coronavirus Disease (COVID-19) Dashboard https://covid19.who.int/ |
国内での接種は本年2月に最前線の医療従事者1万人に安全性情報収集を目的に開始する予定であり、続いて医療従事者300万人、高齢者3~4,000万人に接種を拡大する方針である。昨年中の予防接種法改正により、接種にかかる費用や健康被害により製造販売業者が賠償を求められた場合の費用も国が負担し、接種は国民の努力義務とするが、有効性・安全性が確認できない場合には努力義務を適用しない、という方針が示された。
COVID-19治療薬開発において、検証的試験に基づかないデータによる拙速な承認を目指す方向性が日本医師会[25]、日本製薬工業協会[26]からも批判を受けた。今後のワクチン接種でも、有病率の比較的低い地域における介入の効果を実証しうるデータの集積が求められる。ワクチンはすべてを解決する「魔法の弾丸」ではない[27]。万全の感染対策を講じた上で、今なお実験の途中段階にあるという認識を保持しつつ、段階的な接種の成果を見極めていく必要がある。ワクチン接種プログラムの適正な運用にこそ、「データ稼働型対策」[28,29]が必要不可欠なのである。
地球規模のワクチン配分計画
COVAXの成果と課題
地球規模のパンデミックを克服するためには、世界人口77億9,500万人のうち必要とする人々にあまねくワクチンを届ける計画が求められる。「すべての人々が安全にならなければ誰も安全にならない」という理念のもとに発足したイニシアチブであるCOVAX(COVID-19ワクチン配分計画)には、186カ国・地域が参加し、2020年中に目標としていた20億ドルを超える資金調達を達成した。2021年にはさらに50億ドルが必要とされる。日本はこれに1億3千万ドル(172億円)[30]を拠出しており、英国(7億ドル)、カナダ(2億4,600万ドル)、ビル&メリンダ・ゲイツ財団(1億5630万ドル)、サウジアラビア(1億5千万ドル)、ノルウェー(1億3千万ドル)に次ぐ拠出額である。他に1億ドルを超える資金拠出を行っているのは、EC、フランス、ドイツが各1億1,700万ドル、イタリアが1億300万ドルである[31]。
これにより、低・中所得国92か国に対し合計13億回分のワクチンの供給が可能になる。接種を行う国の規制当局による承認が前提となるが、世界中で最も弱い立場にある人々にもワクチンを届けることを目指している。アストラゼネカのワクチンについては1億7千万回分の契約が成立している。ジョンソン&ジョンソンのワクチンは現在第Ⅲ相試験実施中であるが5億回分についての覚書が締結されている[32]。ファイザー、モデルナのワクチンについては現在交渉中である。
この計画は、Gaviワクチンアライアンス、感染症流行対策イノベーション連合(CEPI)、 WHOにより主導され、高・中所得国が資金拠出し、拠出額に応じて開発に成功したワクチンを購入する研究開発と共同購入の仕組み(COVAXファシリティ)と、政府開発援助(ODA)・民間ドナーからの拠出金によりにより低所得国にもワクチンを提供する枠組(COVAX AMC)を組み合わせている[33]。COVAXファシリティは、自国での生産や二国間協議による開発企業からの供給が十分ではなかった場合のリスクヘッジとする趣旨である。
「試験終了後アクセス」を超えて
地球規模のワクチン配分計画を実効性あるものにするためには、寄附としての拠出金による措置だけではなく、ワクチンの価格が中・低所得国の保健システムでも入手可能なものとなること、欧米先進国以外の製造・供給能力のある国への技術移転とそれらの国々から低所得国への供給が可能となることが求められる。
国境なき医師団(Médecins Sans Frontières: MSF)は、ワクチン開発企業に資金提供した政府に対して、ライセンス供与や技術移転の契約、臨床試験のコストとデータの公表を義務付けるよう求めている[34]。そこで明示しているのは、6つのワクチン開発企業が受けている公的資金の総額は120億ドルであり、EUAを受けた企業についてはファイザー+ビオンテック:25億ドル、モデルナ:24.8億ドル、アストラゼネカ+オックスフォード大学:17億ドルである。アストラゼネカ社はオックスフォード大学との契約に基づきパンデミックが続く間は利益を得ることなくワクチンを原価で販売するとしているが、ブラジルの研究機関との契約の中で2021年7月以降は企業側がパンデミック期間の終了を決定できるとしていることに対して、MSFは警告を発している。
EUA後の供給について、例えばファイザー社の場合、米国には2021年7月までに39億ドルで2億回分(1億人分、米国総人口は約3.2億人)[35]、EUとは3億人分(EU総総人口は4.5億人)[36]、日本とは1億2千万回分(6千万人分、日本の総人口は約1.2億人)[37]、全世界に対しては2021年末までに13億回分供給の計画がある。
「試験終了後アクセス」を提供する倫理的責務は、個別の試験参加者に開発に成功した試験薬を早期に提供するという責務から、一国の医療保健制度の中で開発された製品へのアクセスを必要とするすべての人々に提供する責務へと転換されつつある[38]。COVID-19パンデミックは、この倫理的責務を、開発製品を必要とする地球上のすべての人々のアクセスの保証という課題へと発展させつつある。その根拠は、COVID-19発生率をアウトカムとする検証的試験は、有病率の高い地域で実施せざるを得ず、開発されたワクチンは、そのような感染拡大に苦しむ地域の人々の愛他的精神による地球規模の「連帯」(solidarity)によって達成された「公共財」とみなすべきだからでもある。
おわりに:「ポストコロナ」への道標
新型コロナウイルスの遺伝子配列が明らかにされてから1年未満でワクチンが世界各地に供給され、接種が開始された。この事実は、コロナ禍という世界を襲った未曽有の危機に対し、世界中の産・官・学が英知を結集し、最前線の医療従事者の献身的な協力と積極的に試験に参加した研究対象者の愛他的精神が共鳴した、過去に例をみない協働の証である。
米国での接種第1号となった、ニューヨークの病院でICUのディレクターを務める黒人女性看護師は、我々の歴史の中でもとりわけ痛ましい日々の「終わりの始まり」であり、トンネルの向こうにようやく光がみえた今、なおもマスクをし、ソーシャル・ディスタンスを維持しなければならない、と啓発した[39]。この病院では10万人を超えるCOVID-19患者を治療し、昨年4月のある時点では3,500人の患者を抱えていたという。
ワクチンはウィズコロナ時代を生き抜くための一つのツールだが、すべてを解決する手段ではない。ウィズコロナ状況をどうとらえ、ポストコロナという近未来をいかに展望するのか――最先端の科学的知識をなおも結集しなければならないが、科学によって回答することのできない「トランス・サイエンス的な課題」に対する回答を、倫理、法、経済などの学術分野を超えた協働と患者・市民の参画によって模索し続けなければならない[40]。コロナ禍が浮き彫りにしたのは、パンデミック以前から存在していた「健康の社会的決定要因」や、医療資源配分の不平等・不公正である[27]。ワクチンを伴う感染症対策を、これら既存の諸問題を解決しポストコロナへと導く契機としなければならない。
[引用文献]
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246.
- Food and Drug Administration. Letter of Authorization. December 11. https://www.fda.gov/media/144412/download
- Food and Drug Administration. Letter of Authorization. December 18. https://www.fda.gov/media/144636/download
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Kehtan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Mascola J, Polakowski L, Ledgerwood J, Graham BS, Bennett H, Pajon R, Knightly C, Leav B, Deng W, Zhou H, Han S, Ivarsson M, Miller J, Zaks T; COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020 Dec 30. doi: 10.1056/NEJMoa2035389. Epub ahead of print. PMID: 33378609.
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, Angus B, Baillie VL, Barnabas SL, Bhorat QE, Bibi S, Briner C, Cicconi P, Collins AM, Colin-Jones R, Cutland CL, Darton TC, Dheda K, Duncan CJA, Emary KRW, Ewer KJ, Fairlie L, Faust SN, Feng S, Ferreira DM, Finn A, Goodman AL, Green CM, Green CA, Heath PT, Hill C, Hill H, Hirsch I, Hodgson SHC, Izu A, Jackson S, Jenkin D, Joe CCD, Kerridge S, Koen A, Kwatra G, Lazarus R, Lawrie AM, Lelliott A, Libri V, Lillie PJ, Mallory R, Mendes AVA, Milan EP, Minassian AM, McGregor A, Morrison H, Mujadidi YF, Nana A, O’Reilly PJ, Padayachee SD, Pittella A, Plested E, Pollock KM, Ramasamy MN, Rhead S, Schwarzbold AV, Singh N, Smith A, Song R, Snape MD, Sprinz E, Sutherland RK, Tarrant R, Thomson EC, Török ME, Toshner M, Turner DPJ, Vekemans J, Villafana TL, Watson MEE, Williams CJ, Douglas AD, Hill AVS, Lambe T, Gilbert SC, Pollard AJ; Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020 Dec 8;397(10269):99–111. doi: 10.1016/S0140-6736(20)32661-1. Epub ahead of print. PMID: 33306989; PMCID: PMC7723445.
- US Dept of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research. Guidance for Industry: Development and Licensure of Vaccines to Prevent COVID-19. 2020 Jun.[齊尾武郎,栗原千絵子,訳.COVID-19予防ワクチンの開発及び承認 産業界のためのガイダンス.臨床評価.2020; 48(3): 583-602.]
- Family, ministry say no link to vaccine as man dies hours after inoculation. Dec 28, 2020. The Times of Israel. https://www.timesofisrael.com/family-ministry-say-no-link-to-vaccine-as-man-dies-hours-after-inoculation/
- Denise Grady, Patricia Mazzei. Doctor’s death after covid vaccine is being investigated. The New York Times. Jan. 12, 2021. https://www.nytimes.com/2021/01/12/health/covid-vaccine-death.html
- Lars Erik Taraldsen. Norway Raises Concern Over Vaccine Jabs for the Elderly. Jan 16, Bloomberg.2021. https://www.bloomberg.com/news/articles/2021-01-16/norway-vaccine-fatalities-among-people-75-and-older-rise-to-29
- David Cyranoski. Arab nations first to approve Chinese COVID vaccine — despite lack of public data. Nature. Dec 14, 2020. https://www.nature.com/articles/d41586-020-03563-z
- China gives its first COVID-19 vaccine approval to Sinopharm. Reuters. Dec 31, 2020. https://jp.reuters.com/article/uk-health-coronavirus-vaccine-china/china-gives-its-first-covid-19-vaccine-approval-to-sinopharm-idUKKBN2950AW
- Peru says China’s Sinopharm may resume coronavirus vaccine trial after volunteer’s illness. Reuters. Dec 17, 2020. https://jp.reuters.com/article/us-health-coronavirus-peru-vaccine-idINKBN28Q2ZN
- Tuvan Gumrukcu, Ali Kucukgocmen. Turkey says China’s Sinovac COVID vaccine 91.25% effective in late trials. Reuters. Dec 25, 2020. https://www.reuters.com/article/us-health-coronavirus-turkey-china/turkey-says-chinas-sinovac-covid-vaccine-91-25-effective-in-late-trials-idUSKBN28Y1R1
- Shawna Chen. Sinovac coronavirus vaccine 78% effective in Brazil trials. AXIOS. Jan 7, 2021. https://www.axios.com/covid-vaccine-sinovac-coronavac-brazil-trials-94465da6-8977-482e-858a-e97a3442b0a6.html
- Julia Leite, Andre Romani. Brazil finds Sinovac’s vaccine efficacy well below earlier findings: São Paulo-based Butantan Institute lists an efficacy rate of 50.4%, after pressure for more transparency. Business Day. Jan 12, 2021. https://www.businesslive.co.za/bd/world/americas/2021-01-12-brazil-finds-sinovacs-vaccine-efficacy-well-below-earlier-findings/
- The Gamaleya National Center, Russian Direct Investment Fund. The SputonikⅤ vaccine’s efficacy is confirmed at 91.4% based on data analysis of the final control point of clinical trials. Dec 14, 2020. https://sputnikvaccine.com/newsroom/pressreleases/the-sputnik-v-vaccine-s-efficacy-is-confirmed-at-91-4-based-on-data-analysis-of-the-final-control-po/
- WHOAd Hoc Expert Group on the Next Steps for Covid-19 Vaccine Evaluation. Placebo-controlled trials of covid-19 vaccines—why we still need them. N Engl J Med. 2020. doi: 10.1056/NEJMp2033538.
- Lenzer J. Covid-19: Should vaccine trials be unblinded? BMJ. 2020 Dec 29;371:m4956. doi: 10.1136/bmj.m4956. PMID: 33376088.
- 栗原千絵子,齊尾武郎.国際共同臨床試験の倫理:新型コロナの政治学・ワクチン編.現代思想.2020年11月号.14-27.
- Food and Drug Administration. Emergency use authorization for vaccines to prevent covid-19: guidance for industry. October 2020. https://www.fda.gov/media/142749/download
- Center for Disease Control and Prevention. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine — United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. ePub: 6 January 2021. DOI: http://dx.doi.org/10.15585/mmwr.mm7002e1external icon
- Initial Israeli data: First Pfizer shot curbs infections by 50% after 14 days. The Times of Israel. Jun 12, 2021. https://www.timesofisrael.com/israeli-data-shows-50-reduction-in-infections-14-days-after-first-vaccine-shot/
- 一般社団法人日本感染症学会 ワクチン委員会.COVID-19 ワクチンに関する提言.2020年12月28日.https://www.kansensho.or.jp/uploads/files/guidelines/2012_covid_vaccine.pdf
- 厚生労働省健康局健康課予防接種室. 新型コロナウイルスワクチンの接種体制確保について 自治体説明会①. 令和2年12月18日
- 日本医師会COVID-19有識者会議. 新型コロナウイルス感染パンデミック時における治療薬開発についての緊急提言. May 17, 2020. https://v2020.covid19-jma-medical-expert-meeting.jp/topic/1526
- 大島裕之,青柳充顕,田島雅也,他(日本製薬工業協会 医薬品評価委員会 臨床評価部会).変革を迎えた臨床研究のこれからを考える 臨床エビデンスの活用と規制のあり方-COVID-19の経験から-. 臨床評価.48(3): 535-49. http://cont.o.oo7.jp/48_3/p535-49.pdf
- Dirceu Greco. COVID-19と生命倫理:Part 1 ブラジル生命倫理学会勧告No. 01/2020と直面する課題. 臨床評価.2020; 48(3): 551-74. http://cont.o.oo7.jp/48_3/48_3contents.html
- 永井良三.データ駆動でコロナ克服.日刊工業新聞;2020年12月18日.
- 笠貫宏.第3波感染爆発の危機を迎えて 新たな2つの政策: コロナ検診制度とデータ駆動型対策.臨床評価.2020;48(3):531-4. http://cont.o.oo7.jp/48_3/p531-4.pdf
- 厚生労働省.新型コロナウイルス感染症ワクチンの国際的共同購入枠組み(COVAXファシリティ)に参加します.令和二年九月十五日.
- Gavi. Key Outcomes: COVAX AMC. Dec 18, 2020. https://www.gavi.org/sites/default/files/covid/covax/COVAX-AMC-Donors-Table.pdf
- Stephanie Nebehay, Kate Kelland. COVAX programme doubles global vaccine supply deals to 2 billion doses. Reuters. Dec 18, 2020. https://jp.reuters.com/article/uk-health-coronavirus-covax-idUKKBN28S1SA
- Gavi, the Vaccine Alliance. https://www.gavi.org/
- Médecins Sans Frontières. Governments must demand phrama make all COVID-19 vaccine deals. Nov 11, 2020. https://www.msf.org/governments-must-demand-all-coronavirus-covid-19-vaccine-deals-are-made-public
- Pfizer. News: Pfizer and BioNTech to supply the U.S. with 100 million additional doses of COVID-10 vaccine. Dec 23, 2020. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-supply-us-100-million-additional-doses
- European Commission. Commission proposes to purchase up to 300 million additional doses of BioNTech-Pfizer vaccine. Jan 8, 2021. https://ec.europa.eu/commission/presscorner/detail/en/ip_21_9
- https://www.pfizer.co.jp/pfizer/company/press/2020/2020_12_18.html
- Greco D.下田 和孝,渡邉 裕司,企画・座長.栗原千絵子,企画・訳.国際共同健康関連研究に関する倫理の過去,現在,未来:ユニバーサル・ヘルスケア・アクセスに向けて.臨床評価.2020;48(1): 35-59. http://cont.o.oo7.jp/48_1/48_1contents.html
- WABC-TV New York. Coronavirus News: New York City critical care nurse given first COVID vaccine in the US. Dec 15, 2020. https://abc7ny.com/covid-vaccine-coronavirus-pfizer-ny/8763858/
- 椿 広計,船渡川伊久子,齋藤正也, 遠藤 薫,笠貫 宏. Covid-19パンデミックを乗り超える:科学・社会・医療を繋ぐ課題と展望. 臨床評価.2020; 48(3): 465-530. http://cont.o.oo7.jp/48_3/p465-530.pdf
付録
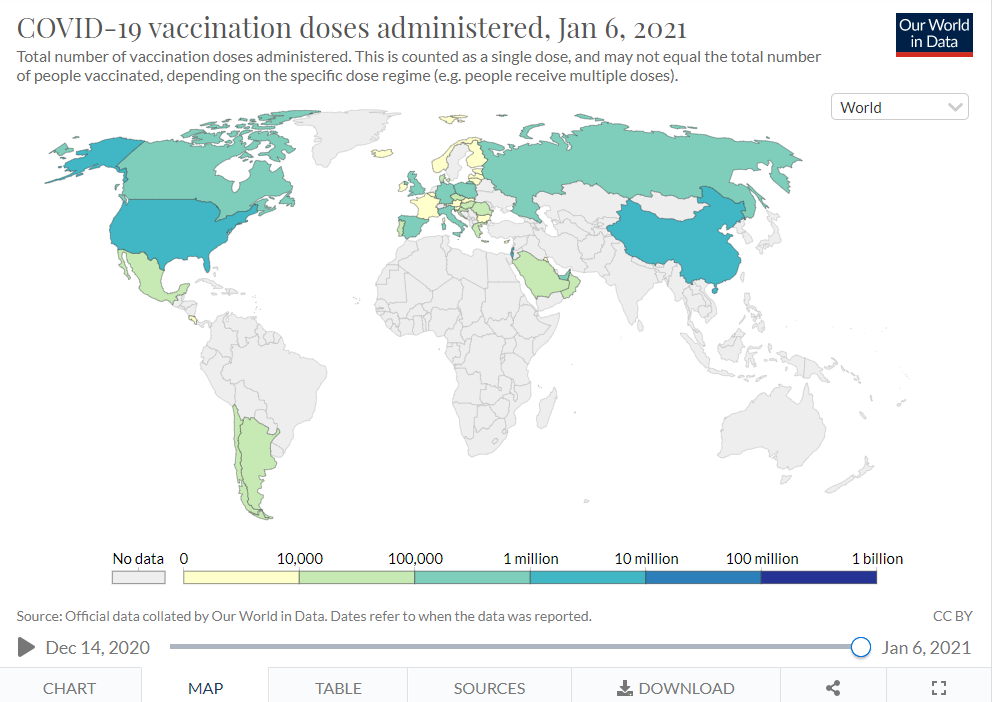
| 図表1-appendix1 |
| 各国における新型コロナワクチン接種回数(地図で表現) |
| 下記出典より使用条件を確認の上転載。 「図表1」のデータを地図上で表現したもの。 1月6日時点で供給が開始されていない国の中にも、まもなく供給されることが予想される国と、そうでない国があるため、今後注視する必要がある。 |
 |
| Source: Our World in Data. Statistics and Research: Coronavirus (COVID-19) Vaccinations Research and data: Hannah Ritchie, Esteban Ortiz-Ospina, Diana Beltekian, Edouard Mathieu, Joe Hasell, Bobbie Macdonald, Charlie Giattino, and Max Roser Web development: Breck Yunits, Ernst van Woerden, Daniel Gavrilov, Matthieu Bergel, Shahid Ahmad, and Jason Crawford https://ourworldindata.org/covid-vaccinations 2021年1月7日アクセス |
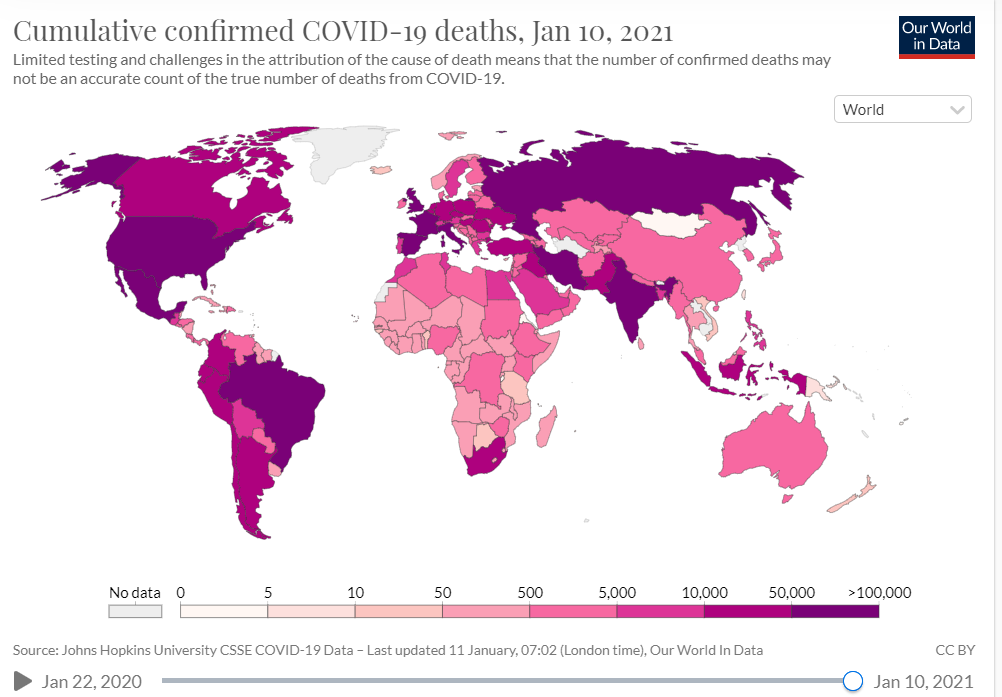
| 図表1-appendix2 |
| 新型コロナウイルス感染症による死者数(地図で表現) |
| 下記出典より使用条件を確認の上転載。 同じデータソースより作成された死者数のマップ。死者数の多い地域に必ずしも早期にワクチンがゆきわたっていないことがわかる。 |
 |
| Source: Our World in Data. Statistics and Research: Coronavirus (COVID-19) Vaccinations Research and data: Hannah Ritchie, Esteban Ortiz-Ospina, Diana Beltekian, Edouard Mathieu, Joe Hasell, Bobbie Macdonald, Charlie Giattino, and Max Roser Web development: Breck Yunits, Ernst van Woerden, Daniel Gavrilov, Matthieu Bergel, Shahid Ahmad, and Jason Crawford https://ourworldindata.org/covid-vaccinations 2021年1月11日アクセス |
| 図表1-appendix3 |
| 各国における新型コロナワクチン接種回数(100人あたりの接種回数) |
| 下記出典より使用条件を確認の上転載。 2021年1月6日までに情報を得た新型コロナワクチン接収の、各国における100人あたりの接種回数。 1月6日以降も接種は進んでいるので、最新情報は下記出典より参照されたい。 |
 |
| Source: Our World in Data. Statistics and Research: Coronavirus (COVID-19) Vaccinations Research and data: Hannah Ritchie, Esteban Ortiz-Ospina, Diana Beltekian, Edouard Mathieu, Joe Hasell, Bobbie Macdonald, Charlie Giattino, and Max Roser Web development: Breck Yunits, Ernst van Woerden, Daniel Gavrilov, Matthieu Bergel, Shahid Ahmad, and Jason Crawford https://ourworldindata.org/covid-vaccinations 2021年1月7日アクセス |
| 図表2- appendix |
| 世界の承認取得した新型コロナワクチン(新規開発品に限る。2021年1月初旬。)(全体像) |
| ※表中の臨床試験に関する記載は、臨床試験番号(NCTは米国の登録番号、他は管轄当局・地域又はWHOの番号。);開発相;試験薬vs対照;開始~終了;予定被験者数・実施地域(施設数);結果掲載誌(Preprintは査読前公表原稿)。本表は文献9に掲載の表にその後の情報を補った。 ※EUによる承認がある場合にEU加盟国個別の調査は行っていない。 |
 |
| [1] Mulligan MJ, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020 Aug 12. doi: 10.1038/s41586-020-2639-4. Epub ahead of print. PMID: 32785213. [2] Family, ministry say no link to vaccine as man dies hours after inoculation. Dec 28, 2020. The Times of Israel. https://www.timesofisrael.com/family-ministry-say-no-link-to-vaccine-as-man-dies-hours-after-inoculation/ [3] Denise Grady, Patricia Mazzei. Doctor’s death after covid vaccine is being investigated. The New York Times. Jan. 12, 2021. https://www.nytimes.com/2021/01/12/health/covid-vaccine-death.html [4] Lars Erik Taraldsen. Norway Raises Concern Over Vaccine Jabs for the Elderly. Jan 16, Bloomberg.2021. https://www.bloomberg.com/news/articles/2021-01-16/norway-vaccine-fatalities-among-people-75-and-older-rise-to-29 [5] Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246. [6] Medicines & Healthcare products Regulatory Agency. Decision: Conditions of Authorisation for Pfizer/BioNTech COVID-19 vaccine. Updated 31 Dec 2020. https://www.gov.uk/government/publications/regulatory-approval-of-pfizer-biontech-vaccine-for-covid-19/conditions-of-authorisation-for-pfizerbiontech-covid-19-vaccine#vaccine-bnt162b2–conditions-of-authorisation-under-regulation-174-2-december-2020 [7] Bahrain approves Pfizer/BioNTech COVID-19 vaccine. Reuters. Dec 5, 2021. https://www.reuters.com/article/us-health-coronavirus-bahrain/bahrain-approves-pfizer-biontech-covid-19-vaccine-idUKKBN28E2ES?edition-redirect=uk [8] Government of Canada. Drug and vaccine authorizations for COVID-19: List of applications received. Date modified Dec 23, 2020. [9] Reem Krimly, Al Arabiya. Coronavirus: Saudi Arabia approves Pfizer-BioNTech COVID-19 vaccine for use. AL ARABIYA. Dec 10, 2020. https://english.alarabiya.net/en/coronavirus/2020/12/10/Coronavirus-Saudi-Arabia-approves-Pfizer-COVID-19-vaccine-for-use [10] Mexico Approves Coronavirus Vaccine. VOA News. Dec 12, 2020. https://www.voanews.com/covid-19-pandemic/mexico-approves-coronavirus-vaccine [11] Food and Drug Administration. Letter of Authorization. December 11. https://www.fda.gov/media/144412/download [12] Kuwait authorizes emergency use of Pfizer-BioNTech vaccine. Kuwait Times. Dec 13, 2020. [13] The Health Sciences Authority. HSA Grants Interim Authorisation for First COVID-19 Vaccine in Singapore. Dec 14, 2020. https://www.hsa.gov.sg/announcements/press-release/interimauth-firstcovid19vaccine [14] Jordan approves Pfizer-BioNTech Covid vaccine. France 24 (©AFP). Dec 15, 2020. https://www.france24.com/en/live-news/20201215-jordan-approves-pfizer-biontech-covid-vaccine [15] Djenane Villanueva, Mohammed Tawfeeq. Costa Rica authorizes emergency use for Pfizer/ BioNtech vaccine against Covid-19. CNN. Dec 16, 2020. https://edition.cnn.com/world/live-news/coronavirus-pandemic-vaccine-updates-12-16-20/h_c797c3563688992581434afa24fbc280 [16] Agencia Nacional de Regulación, Control y Vigilancia Sanitaria. Arcsa autoriza ingreso al país de vacuna Pfizer-BioNTech para el Covid-19. Dec 17, 2020. [17] Fabian Cambero, Natalia A. Ramos Miranda. Chilean health regulator approves Pfizer-BioNTech vaccine for emergency use. Reuters. Dec 17, 2020. https://www.reuters.com/article/health-coronavirus-chile-vaccine-idUSKBN28Q2EZ [18] Panama government approves Pfizer, BioNTech coronavirus vaccine. Hindustan Times. Dec 16. [19] Swiss Agency for Therapeutic Products. Swissmedic grants authorization for the first COVID-19 vaccine in Switzerland. Dec 19, 2020. [20] Qatar approves Pfizer and BioNTech COVID-19 vaccine emergency use -QNA news agency. Reuters. Dec 21, 2020. [21] European Commission. Statement by President von der Leyen on the marketing authorisation of the BioNTech-Pfizer vaccine against COVID-19. Dec 21, 2020. https://ec.europa.eu/commission/presscorner/detail/en/STATEMENT_20_2510 [22] Argentina Grants Emergency Approval to Pfizer/BioNTech Vaccine. The Rio Times. Dec 23, 2020. https://riotimesonline.com/brazil-news/mercosur/argentine-extends-emergency-approval-to-the-pfizer-vaccine/ [23] Iraq grants emergency approval for Pfizer COVID-19 vaccine. Arab News. Dec 27, 2020. [24] World Health Organization. WHO issues its first emergency use validation for a COVID-19 vaccine and emphasizes need for equitable global access. Dec 31, 2020. https://www.who.int/news/item/31-12-2020-who-issues-its-first-emergency-use-validation-for-a-covid-19-vaccine-and-emphasizes-need-for-equitable-global-access [25] Jackson LA, et al. An mRNA Vaccine against SARS-CoV-2 – Preliminary Report [published online ahead of print, 2020 Jul 14]. N Engl J Med. 2020;NEJMoa2022483. doi:10.1056/NEJMoa2022483 [26] Anderson et al. Safety and immunogenicity of SARS-CoV-2 mRNA-1273 vaccine in older adults. N Engl J Med DOI: 10.1056/NEJMoa2028436 (2020) [27] Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Kehtan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Mascola J, Polakowski L, Ledgerwood J, Graham BS, Bennett H, Pajon R, Knightly C, Leav B, Deng W, Zhou H, Han S, Ivarsson M, Miller J, Zaks T; COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020 Dec 30. doi: 10.1056/NEJMoa2035389. Epub ahead of print. PMID: 33378609. [28] Food and Drug Administration. Letter of Authorization. December 18. https://www.fda.gov/media/144636/download [29] Israeli Ministry of Health Authorizes COVID-19 Vaccine Moderna for Use in Israel. Jan 4, 2021. https://investors.modernatx.com/node/10681/pdf [30] European Commission. European Commission authorises second safe and effective vaccine against COVID-19″. https://ec.europa.eu/commission/presscorner/detail/en/ip_21_3 [31] GOV. UK. Moderna vaccine becomes third COVID-19 vaccine approved by UK regulator. Jan 8, 2021. https://www.gov.uk/government/news/moderna-vaccine-becomes-third-covid-19-vaccine-approved-by-uk-regulator [32] Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial [published correction appears in Lancet. 2020 Aug 15;396(10249):466]. Lancet. 2020;396(10249):467-78. doi:10.1016/S0140-6736(20)31604-4 [33] Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, Angus B, Baillie VL, Barnabas SL, Bhorat QE, Bibi S, Briner C, Cicconi P, Collins AM, Colin-Jones R, Cutland CL, Darton TC, Dheda K, Duncan CJA, Emary KRW, Ewer KJ, Fairlie L, Faust SN, Feng S, Ferreira DM, Finn A, Goodman AL, Green CM, Green CA, Heath PT, Hill C, Hill H, Hirsch I, Hodgson SHC, Izu A, Jackson S, Jenkin D, Joe CCD, Kerridge S, Koen A, Kwatra G, Lazarus R, Lawrie AM, Lelliott A, Libri V, Lillie PJ, Mallory R, Mendes AVA, Milan EP, Minassian AM, McGregor A, Morrison H, Mujadidi YF, Nana A, O’Reilly PJ, Padayachee SD, Pittella A, Plested E, Pollock KM, Ramasamy MN, Rhead S, Schwarzbold AV, Singh N, Smith A, Song R, Snape MD, Sprinz E, Sutherland RK, Tarrant R, Thomson EC, Török ME, Toshner M, Turner DPJ, Vekemans J, Villafana TL, Watson MEE, Williams CJ, Douglas AD, Hill AVS, Lambe T, Gilbert SC, Pollard AJ; Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020 Dec 8;397(10269):99–111. doi: 10.1016/S0140-6736(20)32661-1. Epub ahead of print. PMID: 33306989; PMCID: PMC7723445. [34] Medicines & Healthcare products Regulatory Agency. Decision: Conditions of Authorisation for COVID-19 Vaccine AstraZeneca. Published 30 Dec 2020. https://www.gov.uk/government/publications/regulatory-approval-of-covid-19-vaccine-astrazeneca/conditions-of-authorisation-for-covid-19-vaccine-astrazeneca [35] Aislinn Laing. Argentine regulator approves AstraZeneca/Oxford COVID-19 vaccine –AstraZeneca. Reuters. Dec 31, 2020. https://www.reuters.com/article/us-health-coronavirus-argentina-astrazen/argentine-regulator-approves-astrazeneca-oxford-covid-19-vaccine-astrazeneca-idUSKBN29421P [36] El Salvador greenlights AstraZeneca, Oxford University COVID-19 vaccine. Reuters. Dec 31, 2020. https://www.reuters.com/article/us-health-coronavirus-el-salvador-vaccin/el-salvador-greenlights-astrazeneca-oxford-university-covid-19-vaccine-idINKBN2942HQ [37] La República Dominicana aprueba la vacuna de AstraZeneca contra la covid-19. EFE. Dec 31, 2020. https://www.efe.com/efe/america/sociedad/la-republica-dominicana-aprueba-vacuna-de-astrazeneca-contra-covid-19/20000013-4431079 [38] Emily Schmall, Sameer Yasir. India Approves Oxford-AstraZeneca Covid-19 Vaccine and 1 Other. The New York Times. Jan 3, 2021. [39] Bryan Pietsch. Mexico approved the Oxford-AstraZeneca vaccine for emergency use. New York Times. Jan 4, 2021. https://www.nytimes.com/2021/01/04/world/mexico-oxford-astrazeneca-vaccine.html [40] Oxford University-Astrazeneca vaccine: Bangladesh okays it for emergency use. The Daily Star. Jan 4, 2021. https://www.thedailystar.net/frontpage/news/oxford-university-astrazeneca-vaccine-bangladesh-okays-it-emergency-use-2022381 [41] Xia S, et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes: Interim Analysis of 2 Randomized Clinical Trials. JAMA. 2020;324(10):951-60. doi:10.1001/jama.2020.15543 [42] David Cyranoski. Arab nations first to approve Chinese COVID vaccine — despite lack of public data. Nature. Dec 14, 2020. https://www.nature.com/articles/d41586-020-03563-z [43] China gives its first COVID-19 vaccine approval to Sinopharm. Reuters. Dec 31, 2020. https://jp.reuters.com/article/uk-health-coronavirus-vaccine-china/china-gives-its-first-covid-19-vaccine-approval-to-sinopharm-idUKKBN2950AW [44] Peru says China’s Sinopharm may resume coronavirus vaccine trial after volunteer’s illness. Reuters. Dec 17, 2020. https://jp.reuters.com/article/us-health-coronavirus-peru-vaccine-idINKBN28Q2ZN [45] Sui-Lee Wee. Chinese Covid-19 Vaccine Gets Key Push, but Doubts Swirl. New York Times. Dec. 9, 2020. https://www.nytimes.com/2020/12/09/business/china-coronavirus-vaccine-united-arab-emirates.html [46] Egypt licenses China’s Sinopharm COVID-19 vaccine for emergency use: health minister. Xinhua. Jan 3, 2021. http://xinhuanet.com/english/2021-01/03/c_139637781.htm [47] Jordan approves China’s Sinopharm Covid vaccine. France 24. Jan 9, 2021. https://www.france24.com/en/live-news/20210109-jordan-approves-china-s-sinopharm-covid-vaccine [48] Tuvan Gumrukcu, Ali Kucukgocmen. Turkey says China’s Sinovac COVID vaccine 91.25% effective in late trials. Reuters. Dec 25, 2020. https://www.reuters.com/article/us-health-coronavirus-turkey-china/turkey-says-chinas-sinovac-covid-vaccine-91-25-effective-in-late-trials-idUSKBN28Y1R1 [49] Shawna Chen. Sinovac coronavirus vaccine 78% effective in Brazil trials. AXIOS. Jan 7, 2021. https://www.axios.com/covid-vaccine-sinovac-coronavac-brazil-trials-94465da6-8977-482e-858a-e97a3442b0a6.html [50] Julia Leite, Andre Romani. Brazil finds Sinovac’s vaccine efficacy well below earlier findings: São Paulo-based Butantan Institute lists an efficacy rate of 50.4%, after pressure for more transparency. Business Day. Jan 12, 2021. https://www.businesslive.co.za/bd/world/americas/2021-01-12-brazil-finds-sinovacs-vaccine-efficacy-well-below-earlier-findings/ [51] Bolívia autoriza uso de vacinas Sputnik V e CoronaVac contra covid-19. UOL. Jan 6, 2021. https://noticias.uol.com.br/internacional/ultimas-noticias/2021/01/06/bolivia-autoriza-uso-de-vacinas-sputnik-v-e-coronavac-contra-covid-19.htm?cmpid=copiaecola [52] Maikel Jefriando. Indonesia pledges free COVID-19 vaccines, with president first in line. Reuters. Dec 16, 2020. https://www.reuters.com/article/us-health-coronavirus-indonesia-vaccines-idUSKBN28Q102 [53] Turkey receives first shipment of Sinovac’s COVID-19 vaccine. Reuters. Dec 30, 2020. https://jp.reuters.com/article/us-health-coronavirus-turkey-sinovac/turkey-receives-first-shipment-of-sinovacs-covid-19-vaccine-idUSKBN2940DE [54] Zhu FC, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 2020 Jun 13;395(10240):1845-54. doi: 10.1016/S0140-6736(20)31208-3. Epub 2020 May 22. PMID: 32450106; PMCID: PMC7255193. [55] Zhu FC, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396(10249):479-88. doi:10.1016/S0140-6736(20)31605-6 [56] Logunov DY et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 396(10252), 649, e22-e24. [57] The Gamaleya National Center, Russian Direct Investment Fund. The SputonikⅤ vaccine’s efficacy is confirmed at 91.4% based on data analysis of the final control point of clinical trials. Dec 14, 2020. https://sputnikvaccine.com/newsroom/pressreleases/the-sputnik-v-vaccine-s-efficacy-is-confirmed-at-91-4-based-on-data-analysis-of-the-final-control-po/ [58] Russian Direct Investment Fund. Belarus becomes the first foreign country to register the Sputonik V vaccine. Dec 21, 2020. https://rdif.ru/Eng_fullNews/6216/ [59] Argentina approves Russia’s Sputnik COVID-19 vaccine. Reuters. Dec 24, 2020. https://www.reuters.com/article/us-health-coronavirus-vaccine-argentina-idUSKBN28X284 [60] Venezuela firma contrato para la adquisición de la vacuna rusa Sputnik V. Reuters. Dec 30. https://www.reuters.com/article/salud-coronavirus-venezuela-rusia-idLTAKBN2931X2 [61] Serbia to launch vaccination with Russia’s Sputnik V on Jan. 5. TASS. Jan 5, 2021. https://tass.com/society/1242193 [62] Russia says Bolivia has registered Sputnik V vaccine. Reuters, Jan 7, 2021. https://www.reuters.com/article/us-health-coronavirus-russia-bolivia-vac/russia-says-bolivia-has-registered-sputnik-v-vaccine-idUSKBN29B297?edition-redirect=in [63] Jonathan Corum, Carl Zimmer. How Bharat Biotech’s Vaccine Works. The New York Times. Jan 4, 2021. https://www.nytimes.com/interactive/2021/health/bharat-biotech-covid-19-vaccine.html |
| 図表3-appendix |
| 累積感染者数とワクチンⅢ相実施・承認及び死亡率の状況(全体像) |
| WHOの下記サイトより2021年1月7日ダウンロードし著者にて作表。 累積感染者数の多い順に並べ、Ⅲ相試験の実施・ワクチン承認の状況と対比した。 EU加盟国は各国について調査していないがEUとしての承認に基づき企業からの供給を得る契約により各国に供給されるため〇印とした。 ・赤字:100万人中死者数が100人を超える ・赤太字:同1,000人を超える ・水色背景:ASEAN+日本・中国・韓国・台湾 ※台湾はWHOサイトにデータが無いため日本の厚生労働省のデータで補った。 *厚生労働省(日本)より(引用元:台湾当局) |
 |
| WHO Coronavirus Disease (COVID-19) Dashboard https://covid19.who.int/ |
