新型コロナウイルス検査の俯瞰:PCR検査の現状課題と対応を中心に
| 宮地 勇人 | 東海大学医学部 基盤診療学系臨床検査学 教授 |
| COI: | 顧問:株式会社ビー・エム・エル、株式会社SRL 原稿料:株式会社SRL 受託研究・共同研究費:東ソー株式会社、関東化学株式会社 |
- 新型コロナウイルスの疑い患者において、PCR検査を適切に実施することにより、早期診断と拡大防止を行うことが重要である。しかしながら、現在のところSARS-CoV-2 PCR検査は診療ニーズに対して十分に利用出来る状況にない。
- その理由として、アンケートを行ったところ、下記の4つの理由が上がってきている。現在、それぞれの課題への対応は既に図られているが、検査の精度確保や検査要因の確保など解決が困難な問題もある。
- 検査の保険適用(都道府県の医療機関指定と契約)
- 試薬・装置(薬事承認、供給)
- 検査の精度確保
- 検査要員確保
- 検査の精度確保には以下の対応が必要である。
- 検体の取り扱い
- 検査試薬・測定装置の性能評価
- 精度管理物質の利用
- 臨床検査室の能力確保
- 検査要員の資質と訓練
- PCR以外の検査として、抗原検査(EIA)、抗体検査などがある。ただし、抗原検査は検出感度に、抗体検査は診断に時間がかかるという問題がある。POCT用のPCR検査は、米国では一定の施設要件のもとで使用することが許可されており、我が国でも厚生労働省に承認申請の動きがある。それを運用するためには、環境・体制整備の点で特例の措置を要する。
はじめに
中国武漢市を発生源とするSARS-CoV-2(新型コロナウイルス)感染は、WHOにて3月11日にパンデミック宣言がなされ、現在、我が国では新型コロナウイルス感染患者の拡大、院内(施設内)感染の多発など深刻な状況となっている[1-3]。4月7日には緊急事態宣言が初めて発出された。
疑い患者においてSARS-CoV-2のウイルスRNAを検出するpolymerase chain reaction: PCR検査を適切に実施することにより、早期診断と拡大防止を行うことが重要である。国は、SARS-CoV-2のPCR検査の実施件数を伸ばすため様々な方策(保険適用、衛生検査所の施設要件緩和等)を実施してきた[4-6]。その結果、保険適用の指定医療機関は増加し、医療機関内で実施する検査及び外部委託検査の件数が増加し始めている。しかしながら、SARS-CoV-2 PCR検査は診療ニーズに対して十分に利用出来る状況にない。
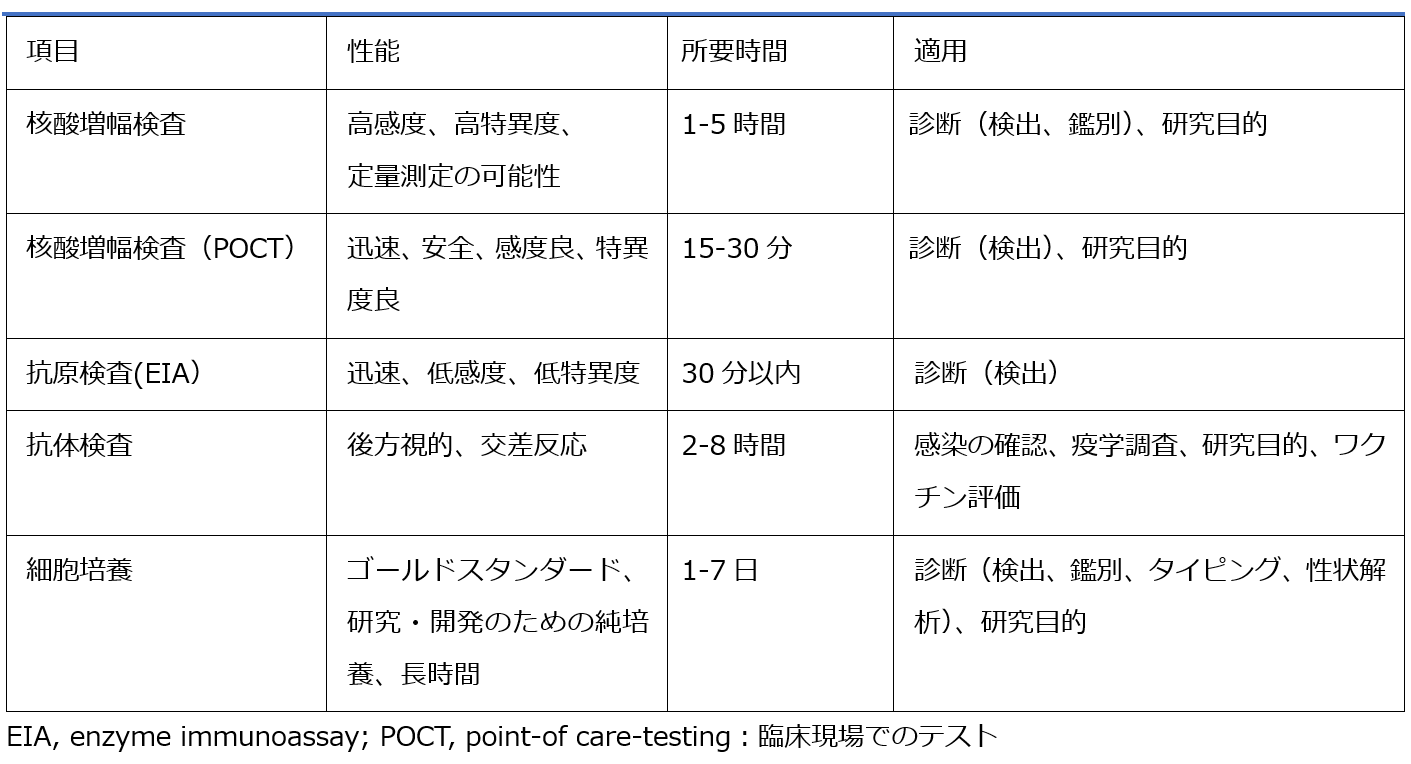
診療現場では、新型コロナウイルス感染症の診断のため、SARS-CoV-2測定の検査技術として、PCR法を含めた核酸増幅法によるSARS-CoV-2 RNA検査(以下、PCR検査)の利用環境の拡大とともに、抗原検査や抗体検査など新たな検査法の利用について期待が高まっている【表1】[7]。そこで、本稿では、SARS-CoV-2 PCR検査実施の課題に対する取り組み状況を概説し、その他のSARS-CoV-2検査の測定技術の展開と意義および利用法について述べる。
| 表1 |
| SARS-CoV-2検査の比較 |
| EIA, enzyme immunoassay; POCT, point-of care-testing [7]を引用改変 |
 |
1. SARS-CoV-2の生物学と測定技術
SARS-CoV-2は、ニドウイルス目・コロナウイルス亜科・コロナウイルス科に分類される[7]。脂質二重膜のエンベロープの中にNucleocapsid(N)蛋白に巻きついたプラス鎖の一本鎖RNAのゲノムを有する。エンベロープ表面にはSpike(S)蛋白、Envelope(E)蛋白、Membrane(M)蛋白が配置している。PCR検査では、一本鎖RNAのSARS-CoV-2特異的な塩基配列(N, S, E, RdRP, Orf1aなど)が検出対象となる。抗原検査では、SARS-CoV-2蛋白(Nucleocapsidなど)に特異的なモノクローナル抗体を用いる。
ヒトコロナウイルス(Human Coronavirus:HCoV)は、本来は動物を宿主としていた動物コロナウイルスがヒトに感染するようになったものである。ヒトに日常的に感染する地域流行性(エンデミック)の4種類: HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1(前2者、後2者それぞれ1960, 2000年代に発見)と流行性(エピデミック)の3種類:SARS-CoV(2003年), MERS-CoV(2012年), SARS-CoV-2(2019年)に分けられる。SARS-CoV -2抗体検査では、特にエンデミックのヒトコロナウイルスへ抗体との交差反応を考慮する必要がある。
2. SARS-CoV-2 PCR検査実施の環境・体制の課題と対応
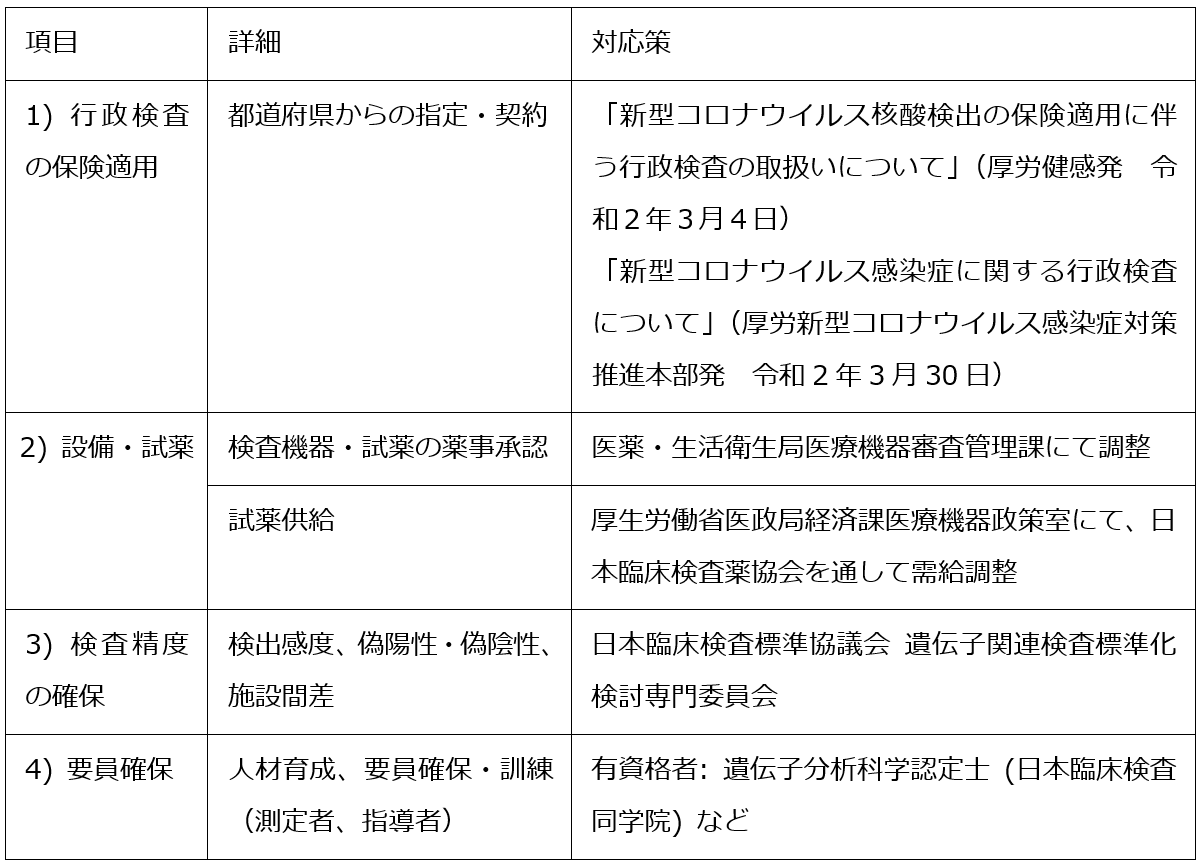
SARS-CoV-2感染患者の拡大に対して、医療機関、衛生検査所ともに検査実施件数が伸びていない(3月末時点)。特に、地域医療の拠点となる大学病院等の医療機関には検査実施開始と件数増加が期待されている。日本臨床検査医学会では、その課題認識のもと、学会評議員に対して、行政検査の保険適用に関する厚生労働省からの通知文の周知とともに、検査実施が進まない背景要因に関する情報についてメールにて緊急のアンケートを行った(回答期間:3月31日~4月6日)。計13施設(内訳:大学病院11施設、一般病院2施設)からの回答内容の分析の結果、検査実施が進まない背景要因は、以下の4つの課題に大別された。それぞれの課題への対応は既に図られている、または進行中であることが確認された【図表2】[8]。
- 検査の保険適用(都道府県の医療機関指定と契約)
- 試薬・装置(薬事承認、供給)
- 検査の精度確保
- 検査要員確保
| 表2 |
| SARS-CoV-2 PCR検査実施の環境・体制の課題と対応策 |
| [8]を引用改変 |
 |
その1について説明する。保健所を通した地方衛生研究所での行政検査は、医師の判断に基づく検査実施が困難であり、保険適用による衛生検査所や医療機関での検査実施の枠組みが重要である。保険適用による行政検査を行う医療機関は、『感染症指定医療機関、それ以外の医療機関で感染症法第19条又は第20条に基づき入院患者が入院している医療機関、帰国者・接触者外来及び帰国者・接触者外来と同様の機能を有する医療機関として都道府県等が認めた医療機関(以下「感染症指定医療機関等」という。)』とされた[5]。「帰国者・接触者外来と同様の機能を有する医療機関として都道府県等が認めた医療機関」について、厚生労働省の通知文「新型コロナウイルス感染症に関する行政検査について」(令和2年3月30日厚生労働省新型コロナウイルス感染症対策推進本部)において、「適切な感染対策が講じられている医療機関として都道府県等が認めた医療機関を指しているものである。」との解釈が明確化され、都道府県からの指定は医療機関の「申し出」に基づくとされた[6]。これら厚生労働省からの一連の通知と周知により、保険適用の行政検査を委託された指定医療機関が増加し、それに伴い保険適用の行政検査として、医療機関での検査及び外部委託検査の件数が増加し始めている[2]。一方、「都道府県等が認めた医療機関」の指定の基準や時期は、必ずしも一律のものとなっていない。都道府県等の判断は、地域での患者発生・入院患者状況や行政検査(保健所を通した)の実施件数など諸事情を考慮しているものと推定される。「適切な感染対策が講じられ、検査実施の準備が出来ている医療機関」の指標の1つとして、都道府県の要請に基づき、発症患者の入院受け入れを行っている場合が挙げられる。
2 試薬・装置の薬事承認と供給については、厚生労働省にて調整が行われている。
3 検査の精度確保と 4 検査要員の確保は、医療機関の臨床検査室での対応が引き続き必要な課題である。
3. SARS-CoV-2 PCR検査の精度確保の課題と対応
(1)検体の取り扱い
SARS-CoV-2 PCR検査の精確な結果には、適切な検体を適切な時期に採取する必要がある[9]。発症48時間前から気道検体にてSARS-CoV-2 RNAがしばしば検出され、感染源となりうる[10]。SARS-CoV-2 PCR検査には、主に気道由来検体が用いられる。上気道由来検体では、咽頭ぬぐい液、鼻咽頭ぬぐい液、鼻咽頭吸引液、唾液、下気道由来検体では、喀痰、気管支肺胞洗浄液が用いられる。下気道にウイルス量が多いため、喀痰など下気道由来検体の採取が望ましい。上気道由来検体としては、鼻咽頭ぬぐい液は、咽頭ぬぐい液より検出率が高く、その使用が推奨される(臨床的感度70-80%程度)[11,12]。ぬぐい液は、滅菌綿棒(フロックスワブなど)で採取し、 2mLのウイルス搬送培地(VTM/UTM)または0.5%BSA加PBSに漬ける。採取した検体の保存は、冷蔵庫(2-8℃)で48(72)時間まで、長期保存は-70℃以下の冷凍庫で行う。自己採取の唾液検体は、91.7% (11/12) と高い陽性率が報告されている[13]。
(2)検査試薬・測定機器
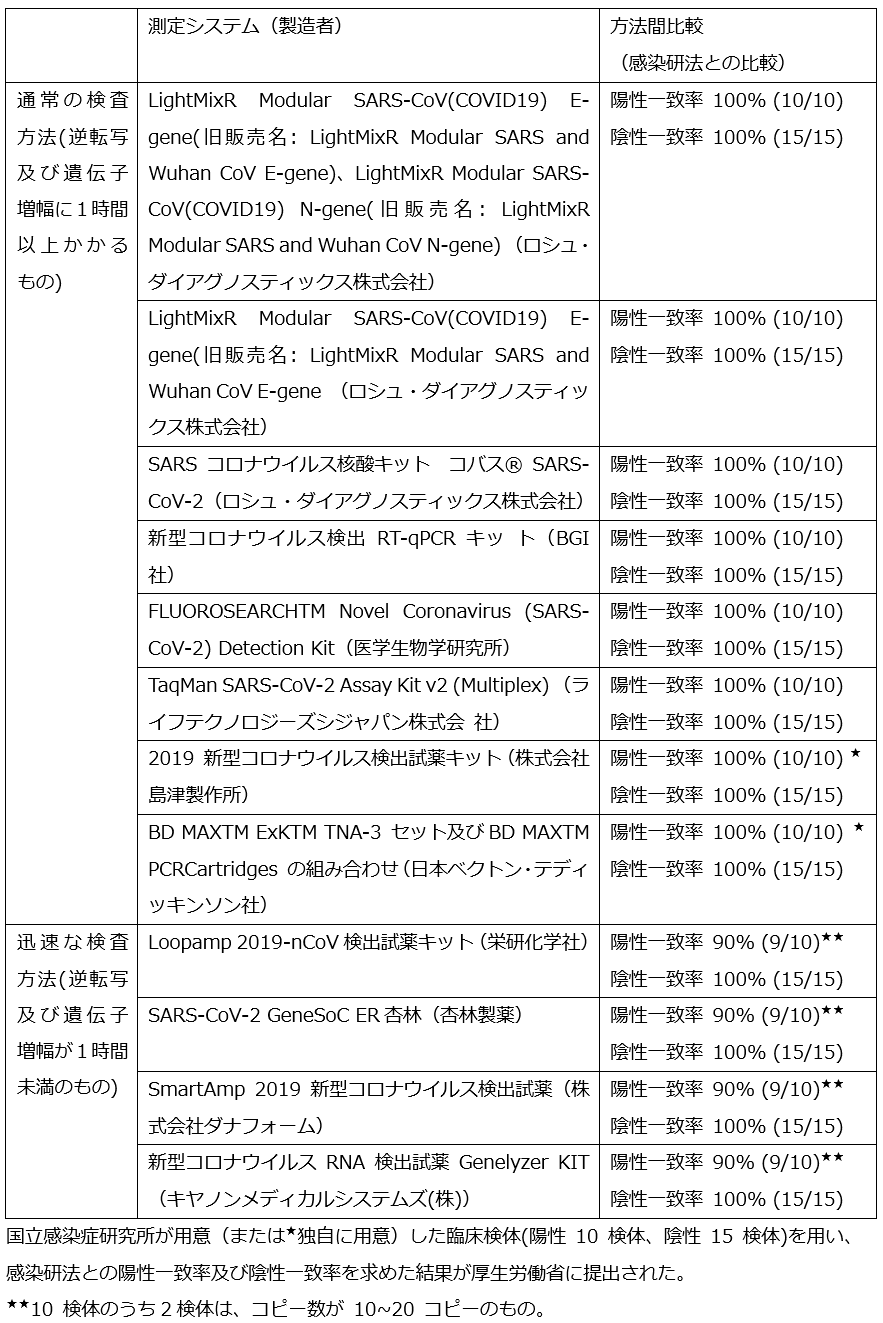
我が国で使用可能な検査試薬・測定機器は、国立感染症研究所が作成した「病原体検出マニュアル2019-nCoV」に記載された方法(感染研法)を中心に、これに準じたものとして、【表3】のごとく整理される[14]。
厚生労働省の通知文「新型コロナウイルスに関する検査体制の確保について」(令和2年2月 14 日厚生労働省健康局結核感染症課)において、国立感染症研究所の病原体検出マニュアルに基づくリアルタイムPCR検査で用いられるプライマー・プローブとポジティブコントロールの医療機関への提供について通知がなされた[15,16]。それに基づき、供給された試薬を用いた感染研法による検査実施を開始した施設が多い。
課題として、測定システムの分析的妥当性、臨床的妥当性等の性能評価に関する情報は限られている。臨床検体を用いた感染研法との比較評価結果が公開されている[14]。国立感染症研究所が用意または独自の臨床検体(陽性 10 検体、陰性 15 検体)を用い、感染研法との陽性一致率及び陰性一致率を求めたSARS-CoV-2 PCR検査法について、結果が厚生労働省に提出されている。そのうち、陽性一致率および陰性一致率ともに 90%以上を示した結果は、【表3】のごとくである。これらは、保険適用された新型コロナウイルスのPCR検査「SARS-CoV-2(新型コロナウイルス)核酸検出」を実施する際に用いるものに該当する。感染研が用意した臨床検体10 検体のうち2検体は、コピー数が低値(10~20 コピー)であった。迅速な検査方法(RNA抽出、逆転写および遺伝子増幅が1時間未満のもの)は、何れも陽性一致率が90%で、コピー数低値で陰性となる可能性がある。実際の運用における検出感度は、RNA抽出方法との組合せに依存する。RNA抽出方法の選択と検査目的にかなう性能評価(妥当性確認)は、運用導入を考慮する臨床検査室の責任で行う必要がある(後述)。
令和2年3月27日、シスメックス株式会社が申請したリアルタイムPCR装置を用いた新型コロナウイルス検出診断キット「2019-nCoV検出蛍光リアルタイムRT-PCRキット」が製造販売後に臨床性能を評価することを承認条件とした上で、体外診断用医薬品(in vitro diagnostics: IVD)として初めて承認された。その後、3月31日に「Loopamp新型コロナウイルス2019(SARS-CoV-2)検出試薬キット」(栄研化学株式会社)、4月7日に「コバス SARS-CoV-2」(ロシュ・ダイアグノスティックス株式会社)と製造販売承認・保険適用が続いている。コバスSARS-CoV-2 は試料の調製から増幅および測定まで全工程を「コバス 6800 システム」または「コバス 8800 システム」にて自動で行うハイスループット測定システムである。その導入は、試料の調製に必要であった人的負担の軽減とともに、測定件数の大幅な増加につながると期待される
| 表3 |
| SARS-CoV-2 PCR検査の種類と測定性能の方法間比較(4月21版) |
| [14]参照 |
 |
(3)精度管理物質
発症者や濃厚接触者において、陰性結果が後日陽性化する事例が多数報告され、また有効な治療にて陰性結果を確認後に再度陽性化する事例も報告されている。特に、検体中のウイルス量が少ない検体や治療後において偽陰性結果となりやすい。その一因として、測定性能として安定した検出限界が必ずしも確保できていない状況がある。
対策として、信頼性ある検出限界の確保には、安定した低ウイルス量の精度管理物質による核酸抽出工程と増幅工程の性能評価が必要となる。施設間差を解消するため、精度管理物質を用いた外部精度管理調査に基づく是正が求められる。このような精度管理物質として、AcroMetrixTM Coronavirus 2019 (COVID-19) RNA Control (Thermo Fisher Diagnostics 株式会社)、AccuPlex™ SARS-CoV-2(SeraCare社)、The EDX SARS-CoV-2 Standard(Exact Diagnostics社)等が、4月になり販売開始され、我が国でも入手可能となった[8]。
(4)臨床検査室の能力
医療機関が自ら実施する遺伝子関連検査においては、検体検査の品質・精度確保に係る医療法等の一部改正とそれに伴う厚生労働省関係省令の整備に関する省令(省令改正)(2018年12月1日施行)を遵守する[17]。具体的には、精度の確保に係る責任者の配置および標準作業書・作業日誌の作成のもと、内部精度管理と研修が義務化されている。
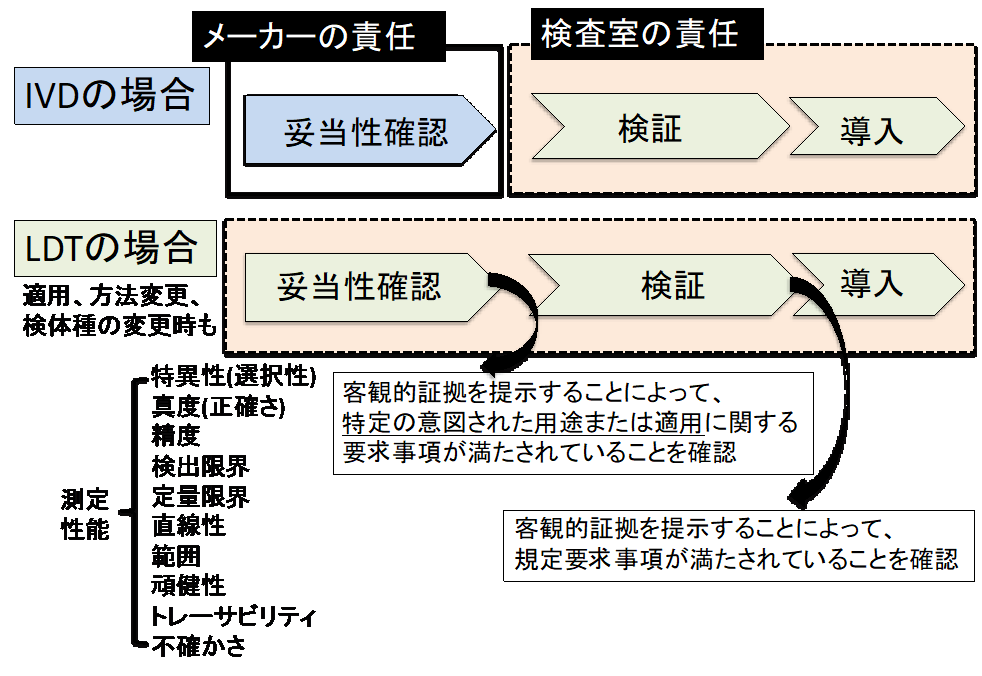
感染研法をはじめ薬事未承認の研究用試薬による検査室独自開発の検査(laboratory developed tests: LDT)の運用において、解決すべき様々な課題がある。体外診断用医薬品の性能評価(妥当性確認)は、薬事承認申請を行う際に企業が責任をもって行い、その情報は検査室に提供される。一方、薬事未承認の測定システムの性能評価(妥当性確認、検証)は、運用導入を考慮する臨床検査室の責任で行う必要がある【図1】。その妥当性確認による性能評価に基づき、内部精度管理を実施していくこととなる。したがって、薬事未承認の検査試薬・測定機器の導入には、臨床検査室には相応の能力が必要である[18]。その際、「遺伝子関連検査のためのISO 15189ガイダンス文書」(日本臨床検査標準協議会)が参考となる[18]。体外診断薬においても、結果判定には、その判定域値での再現性に基づく必要がある。特に低いコピー数のウイルス検出の信頼性は、各施設での運用にあたり、導入時に臨床検査室の責任で検証する必要がある。
| 図1 |
| 検査導入時の妥当性確認と検証 |
| 体外診断用医薬品(in vitro diagnostics: IVD)と異なり、検査室独自開発の検査(laboratory developed tests: LDT)では、臨床検査室が検査の妥当性確認・検証に責任をもつ。 (提出コロナRNA) |
 |
信頼性ある検査データは、良質な患者診療(診断、病勢判断、治療効果判定)と感染対策の指標やサーベイランスデータの信頼性確保においてきわめて重要である。検出感度、検出限界、偽陽性・偽陰性結果など分析的妥当性に関する測定性能の違いによる施設間差については、対応すべき喫緊の課題である。 国際的な枠組みでの感染動向の把握や新規治療薬の評価においては、「遺伝子関連検査に関する日本版ベストプラクティスガイドライン(日本版ベストプラクティスガイドライン)」(日本臨床検査標準協議会)の要求水準が必要である[19]。具体的には、精度保証のための外部精度管理調査の実施さらには臨床検査室の第三者施設認定など環境・体制の整備が必要である。
(5)検査要員の確保
測定者の課題として、遺伝子関連検査に関する経験と知識を有し、適切な患者検体の取り扱い、RNA抽出や精度管理を実施する測定者の人材育成や要員不足がある。その候補として、「医療法等の一部を改正する法律の一部の施行に伴う厚生労働省関係省令の整備に関する省令の施行について」(平成30年8月10日 厚生労働省医政局長)において、遺伝子関連・染色体検査の専門知識及び経験を有する他の職種の例として言及された日本臨床検査同学院の遺伝子分析科学認定士資格がある(初級資格保有者 計956名、一級資格保有者 計23名、2020年4月現在)[20, 21]。
要員確保においては、検体測定・精度確保に係る人材とともに、検体採取や検体前処理における感染リスク防止の要員訓練が必要である[22]。国際規格ISO 35001(試験室と他の関連施設のためのバイオリスクマネジメント)には、最小限の安全基準とバイオリスクアセスメントに基づいたリスク低減対策の実践(対応策の計画、導入、評価)、必要な人材の力量と訓練、組織としての各役割の責任の明確化が記述されている(2019年発行)[22]。本規格は、有害な生物学的物質の保存、搬送、廃棄する全ての検査室と関連検査室に適用される。
4. SARS-CoV-2 PCR検査の技術展開
急速な感染拡大において、良質な患者診療と効果的な感染対策には、迅速な検査報告が必要であるPOCT(Point of Care Testing:臨床現場でのテスト)用のPCR検査、特にRNA抽出を統合したものは、迅速性のみならず、安全性の点で有用性がある[7]。呼吸器感染ウイルスのPOCT検査として、ID NOWTM(Abbott)、Xpert X press (Cepheid)、cobas Liat(Roche)は咽頭ぬぐい液用にアメリカ食品医薬品局(Food and Drug Administration; FDA)承認(CLIA-waived)されている。FilmArray Respiratory EZ Panel (BioFire)は、季節性コロナウイルスを含む14種の呼吸器感染病原体(ウイルス、細菌)が測定パネルに組み込まれている。これらの測定システムはSARS-CoV-2 PCR検査用として利用展開が進められている。
米国では既に、POCT用のSARS-CoV-2 PCR検査のFDA未承認薬について、緊急使用許可権限(Emergency Use Authorization:EUA)にて臨床検査室改善法(CLIA:Clinical. Laboratory Improvement Amendments)認証された臨床検査施設にて使用することが許可されている。
現在、これらFDA未承認薬は厚生労働省に承認申請の動きがある。しかしながら、これらを我が国で用いる上での課題として、米国の緊急使用許可権限の前提となる臨床検査室改善法認証の基準となる臨床検査室の第三者認定の状況が異なる。我が国では、臨床検査室の第三者認定は、欧米諸国と異なり義務化されておらず任意である。前述の検体検査の品質・精度確保に係る医療法等の改正(2018年12月1日施行)では、遺伝子関連検査を実施する臨床検査室の第三者認定は環境・体制整備の状況を鑑みて義務化は見送られ、勧奨とされた[17]。薬事未承認薬を用いた遺伝子関連検査を対象としたISO 15189施設認定プログラムは2020年3月から本格審査が開始されたばかりである[18]。したがって、POCT用のPCR検査を我が国で運用するには、環境・体制整備の点で特例の措置を要する。
5. その他のSARS-CoV-2検査
(1)抗原検査
ウイルス特異的抗原を検出する迅速診断法が検討されている。特に、イムノクロマト法によるウイルス特異抗原検出法は、特別な装置を必要とせず目視判定による定性測定ができ、外来やベットサイドで迅速かつ簡便な検査法として、診療現場への導入が期待されている。しかしながら現時点で、イムノクロマト法や酵素免疫法(EIA)を用いた迅速抗原測定は、検出感度の不良が大きな課題である[7]。課題対応として、SARS-CoV-2蛋白特異的なモノクローナル抗体の開発とともに、検出試薬としてコロイド金標識IgGの採用、抗原濃縮や検出プロセスの増幅など検出の高感度化の試みがなされている。早期診断に利用可能な高感度な抗原検査法として、Nucleocapsid蛋白抗原を検出する蛍光イムノクロマト法が報告されている[23]。
(2)抗体検査
血中のウイルス特異的抗体を検出する血清学的診断法が検討されている[7]。イムノクロマト法や酵素免疫法(EIA)を利用した抗体検査に必要な血液検体は、採取が比較的簡単で、検体採取時の医療従事者への感染リスクは低い。しかしながら、SARS-CoV-2抗体検査は、発症から抗体検出まで日数を要し、早期診断には利用出来ない。SARS-CoV-2特異的IgG、IgMは、発症後5日以降に陽性化するとの報告がある[24]。抗体測定システムの測定性能は、使用している抗原の性状や試薬の違いなどにより、臨床的感度・特異度が異なる。抗体測定試薬の性能評価(妥当性確認)には、分析的特異度として、他のヒトコロナウイルス感染した患者のコホート検体を用いた血中の抗体との交差反応の確認が必要である。
抗体検査は、感染(既往)の確認ができ、ウイルス感染拡大の状況や無症候感染の役割など疫学的調査さらにワクチン効果の評価に利用できる。
おわりに
医療機関において院内感染が一度発生した折には、期待される役割を遂行・継続することが困難となる。医療従事者における職業感染やそれを介する院内感染拡大は、一般診療とともに新型コロナウイルス感染に対する医療サービスを窮迫させる。院内感染防止の上で、医療機関内での検査実施の役割は大きい。院内検査として導入したSARS-CoV-2 PCR検査は、その迅速性と柔軟な運用から、感染患者の確定や院内感染の早期発見に基づく早期隔離に加えて、患者コホート化による拡大防止や対策効果モニタリングによる封じ込めに大きく貢献する。感染源となりうる無症候性キャリアの拾い上げにも有用である[引用文献25-27]。SARS-CoV-2 PCR検査は感染症状発症の医療スタッフの管理において、回復後に診療復帰する際の指標(陰性確認)にも活用できる。
一方、SARS-CoV-2 PCR検査は、タイムリーに利用できない医療機関も多く、また検査実施した場合でも検体不良等のため検査結果が判定不能または偽陰性と考えられる事例が想定される。これらSARS-CoV-2 PCR検査の限界を補完する用途として、抗原検査や抗体検査の利用の可能性があり、高感度の抗原検査や特異度の高い抗体検査の開発と実用化が期待される。SARS-CoV-2のように新たな病原体による感染症(新興感染症)への対応には、薬事未承認の測定システムを含めて、新規技術の評価に基づく導入運用が必要であり、国レベルでの環境・体制整備とともに、臨床検査室には相応の能力を確保することが望まれる。
[引用文献]
- World Health Organization. Coronavirus disease (COVID-19) Pandemic. https://www.who.int/emergencies/diseases/novel-coronavirus-2019 (閲覧日2020年4月30日)
- 厚生労働省. 新型コロナウイルス感染症について. https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000164708_00001.html (閲覧日2020年4月30日)
- 厚生労働省. 全国クラスターマップ https://mhlw-gis.maps.arcgis.com/apps/opsdashboard/index.html#/c2ac63d9dd05406dab7407b5053d108e (閲覧日2020年4月30日)
- 厚生労働省 「新型コロナウイルス感染症に係る病原体核酸検査のみを行うために衛生検査所を臨時的に開設する場合の取扱いについて」(令和2年3月5日) https://www.mhlw.go.jp/content/000604549.pdf (閲覧日2020年4月30日)
- 厚生労働省「新型コロナウイルス核酸検出の保険適用に伴う行政検査の取扱いについて」(令和2年3月4日) https://www.mhlw.go.jp/content/000604470.pdf (閲覧日2020年4月30日)
- 厚生労働省「新型コロナウイルス感染症に関する行政検査について」(令和 2年 3月 30日 ) http://www.hospital.or.jp/pdf/20_20200330_01.pdf(閲覧日2020年4月30日)
- Loeffelholz MJ, Tang YW. Laboratory diagnosis of emerging human coronavirus infections – the state of the art. Emerg Microbes Infect. 2020 Dec;9(1):747-756. doi: 10.1080/22221751.2020.1745095.
- 日本臨床検査医学会. SARS-CoV-2(新型コロナウイルス)核酸検出検査の体制の課題対応について. https://www.jslm.org/committees/COVID-19/20200413-1.pdf (閲覧日2020年4月30日)
- 2019-nCoV (新型コロナウイルス)感染を疑う患者の 検体採取・輸送マニュアル 〜2020/04/16 更新版〜 https://www.niid.go.jp/niid/images/pathol/pdf/2019-nCoV_200416.pdf (閲覧日2020年4月30日)
- Centers for Disease Control and Prevention. Interim U.S. Guidance for Risk Assessment and Public Health Management of Healthcare Personnel with Potential Exposure in a Healthcare Setting to Patients with Coronavirus Disease 2019 (COVID-19). https://www.cdc.gov/coronavirus/2019-ncov/hcp/guidance-risk-assesment-hcp.html (閲覧日2020年4月30日)
- Long C, Xu H, Shen Q, Zhang X, Fan B, Wang C, Zeng B, Li Z, Li X, Li H. Diagnosis of the Coronavirus disease (COVID-19): rRT-PCR or CT? Eur J Radiol. 2020 May;126:108961. doi: 10.1016/j.ejrad.2020.108961. Epub 2020 Mar 25.
- Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, Tao Q, Sun Z, Xia L. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology. 2020 Feb 26:200642. doi: 10.1148/radiol.2020200642. [Epub ahead of print]
- To KK, Tsang OT, Chik-Yan Yip C, Chan KH, Wu TC, Chan JMC, Leung WS, Chik TS, Choi CY, Kandamby DH, Lung DC, Tam AR, Poon RW, Fung AY, Hung IF, Cheng VC, Chan JF, Yuen KY. Consistent detection of 2019 novel coronavirus in saliva. Clin Infect Dis. 2020 Feb 12. pii: ciaa149. doi: 10.1093/cid/ciaa149. [Epub ahead of print]
- 厚生労働省健康局結核感染症課. 国立感染症研究所 臨床検体を用いた評価結果が取得された 2019-nCoV 遺伝子検査方法について. https://www.niid.go.jp/niid/images/lab-manual/2019-nCoV-17-20200421.pdf(閲覧日2020年4月30日)
- 厚生労働省「新型コロナウイルスに関する検査体制の確保について」(令和2年2月25日 ) https://www.mhlw.go.jp/content/000600570.pdf(閲覧日2020年4月30日)
- 国立感染症研究所「病原体検出マニュアル2019-nCoV」https://www.niid.go.jp/niid/images/lab-manual/2019-nCoV20200304v2.pdf (閲覧日2020年4月30日)
- 宮地勇人. 検体検査の品質・精度確保に係る医療法等の改正の経緯と意義. Medical Technology 臨時増刊2018年12月; 46(13): 1248-1252.
- 日本臨床検査標準協議会.遺伝子関連検査のためのISO 15189ガイダンス文書. 学術広告社.東京.2019年11月.
- 日本臨床検査標準協議会.遺伝子関連検査に関する日本版ベストプラクティス・ガイドライン解説版.学術広告社.東京.2016年3月. http://www.jccls.org/techreport/bestpractice_guideline.pdf
- 厚生労働省「医療法等の一部を改正する法律の一部の施行に伴う厚生労働省関係省令の整備に関する省令の施行について」(平成30年8月10日)https://www.ajhc.or.jp/siryo/20180810-2.pdf(閲覧日2020年4月30日)
- 宮地 勇人. 検体検査の品質・精度の確保に係る医療法等の改正と専門資格. 臨床病理2019年3月; 67(3): 261-265.
- 宮地 勇人. ISO 15189 の現状とCWA15793 のISO 化(ISO 35001)の動向. JBSA Newsletter . 2020; Vol.10 No.1. 1-7.
- Bo Diao, Kun Wen, Jian Chen, Yueping Liu, Zilin Yuan, Chao Han, Jiahui Chen, Yuxian Pan, Li Chen, Yunjie Dan, Jing Wang, Yongwen Chen, Guohong Deng, Hongwei Zhou, Yuzhang Wu. Diagnosis of Acute Respiratory Syndrome Coronavirus 2 Infection by Detection of Nucleocapsid Protein https://www.medrxiv.org/content/10.1101/2020.03.07.20032524v1.full.pdf
- Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, Wang YY, Xiao GF, Yan B, Shi ZL, Zhou P. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect. 2020 Feb 17;9(1):386-389. doi: 10.1080/22221751.2020.1729071. eCollection 2020.
- Arons MM, Hatfield KM, Reddy SC, et al. Presymptomatic SARS-CoV-2 infections and transmission in a skilled nursing facility. N Engl J Med. DOI: 10.1056/NEJMoa2008457.
- Wei WE, Li Z, Chiew CJ, Yong SE, Toh MP, Lee VJ. Presymptomatic transmission of SARS-CoV-2 — Singapore, January 23–March 16, 2020. MMWR Morb Mortal Wkly Rep 2020;69:411-415.
- Tong Z-D, Tang A, Li K-F, et al. Potential presymptomatic transmission of SARS-CoV-2, Zhejiang Province, China, 2020. Emerg Infect Dis 2020;26:1052-1054.
その他の主要な参考文献・ガイドライン
- 日本臨床検査標準協議会. 遺伝子関連検査 検体品質管理マニュアル. 学術広告社.東京.2011年12月
- 日本臨床検査標準協議会. 遺伝子関連検査 検体品質管理マニュアル(パート2). 新規測定技術・解析試料の品質管理. 学術広告社.東京.2017年10月
