COVID-19に対する候補薬剤及び開発状況
| 國土 典宏 | 国立国際医療研究センター 理事長 |
| 杉浦 亙 | 同 臨床研究センター長 |
| 三上 礼子 | 同 臨床研究センター部長 |
| 渡部 克枝 | 同 臨床研究センター室員 |
| 満屋 裕明 | 同 研究所長 |
| COI: | 杉浦:2019年1月-6月 ViiV Healthcare社員、2019年7月-2020年3月 BioMerieux社員 |
- 現在多くの研究者や製薬企業がSARS-CoV-2を克服すべく、治療薬の開発を急調で進めている。同時に、SARS-CoV-2に特異的な薬剤が開発されるまでの繋ぎとして、既存薬の中で治療薬の探索が進められている。
- 作用機序別に国内外の候補薬剤の開発状況をまとめると、9種類の既存薬に対して22の試験が実施されている。うち実施中:14試験、終了:5試験、計画中:3試験となっている。
- レムデシビルは我が国では未承認の薬剤であるが、有効性が実証されている。今後レムデシビルがCOVID-19の標準治療として位置づけられる可能性が高い。
- ファビピラビル(アビガン)に関しては、国内外において複数の試験が実施されているが、現時点ではCOVID-19に対する有効性を示す論文は発表されていない。
- ロピナビル/リトナビル合剤(カレトラ)に関しては、現時点で有効性を示すデータはない。
- クロロキン(プラケニル)も、現時点では有効性が確認されていない。
- 以上、多くの既存薬がCOVID-19の治療薬候補として挙げられ、試験が進められている。しかし、これらの薬剤はSARS-CoV-2を狙って作られたものではないため、その有効性は限定的と考られる。
- 根本的な問題の解決はSARS-CoV-2特定的な治療薬の開発を期待するしかない。
はじめに
感染者295万人、死者20万人、これはWHOが公表している世界におけるCOVID-19の状況である(4月28日現在)[1]。2019年12月31日中国武漢市に起こった原因不明の重症肺炎の報告[2]を端緒にSARS-CoV-2は瞬く間に感染を広げ、僅か3ヶ月の間に5大陸全てを席巻し、人類史に残るパンデミックを惹き起こしている。
ヒトに感染するコロナウイルスは今までに6種類が報告されているが、もっとも身近なものは、いわゆる風邪(common cold)の原因である4種類のCoronavirus HKU1, NL63, 229E OC43である[3,4]。それに加え、2000年の Severe Acute Respiratory Syndrome (SARS) virus [5] 、そして2012年のMiddle East Respiratory Syndrome (MARS) virusがある[6]、今回のSARS-CoV-2 は7番目のヒトコロナウイルスであり、遺伝子的・病態的にSARSに近いと考えられている[7,8]。
SARSは限局的な流行であったために、我々は免疫学的に全くnaïveの状態で、SARS-CoV-2を迎えることとなった。そして治療法も予防法も確立していないため、各国とも、中世のペスト禍のごとく、外出の自粛、国境閉鎖、都市閉鎖などの物理的遮蔽による感染防御措置を取らざるを得ない状況下に置かれている。しかしながら、中世当時との決定的な違いは、我々は、フレミングによるペニシリンの発見から近年のHIV/AIDSに至るまで、多くの感染症と戦い克服してきた経験と医学的知識そして研究基盤を有していることである[9,10]。
現在多くの研究者や製薬企業がSARS-CoV-2を克服すべく、治療薬の開発を急調で進めているが、SARS-CoV-2に特異的な薬剤が開発されるまでの繋ぎとして、既存薬の中で多少でもSARS-CoV-2増殖を抑える抗ウイルス薬剤とARDSに対する治療薬の探索が進められている。
本稿は現在国内あるいは国外において進められている、既存薬を中心とした臨床試験についてまとめたものである。
既存薬を用いたCovid-19治療法開発手順
抗ウィルス薬の開発の一般的な手順を【図1】に示す。
| 図1 |
| 既存薬を用いたCovid-19治療法開発手順 |
| 1. NCGM研究所満屋研究室(personal communication)、Wang M, et al., Cell Res 2020; 30: 269-271 2. 2020年4月29日 NIH/NIAID 国際共同試験中間報告 (https://www.nih.gov/news-events/news-releases/nih-clinical-trial-shows-remdesivir-accelerates-recovery-advanced-covid-19) オレンジ:有効性が確定している、黄色:論文報告あり、緑:進行中、薄いグレー:情報なし |
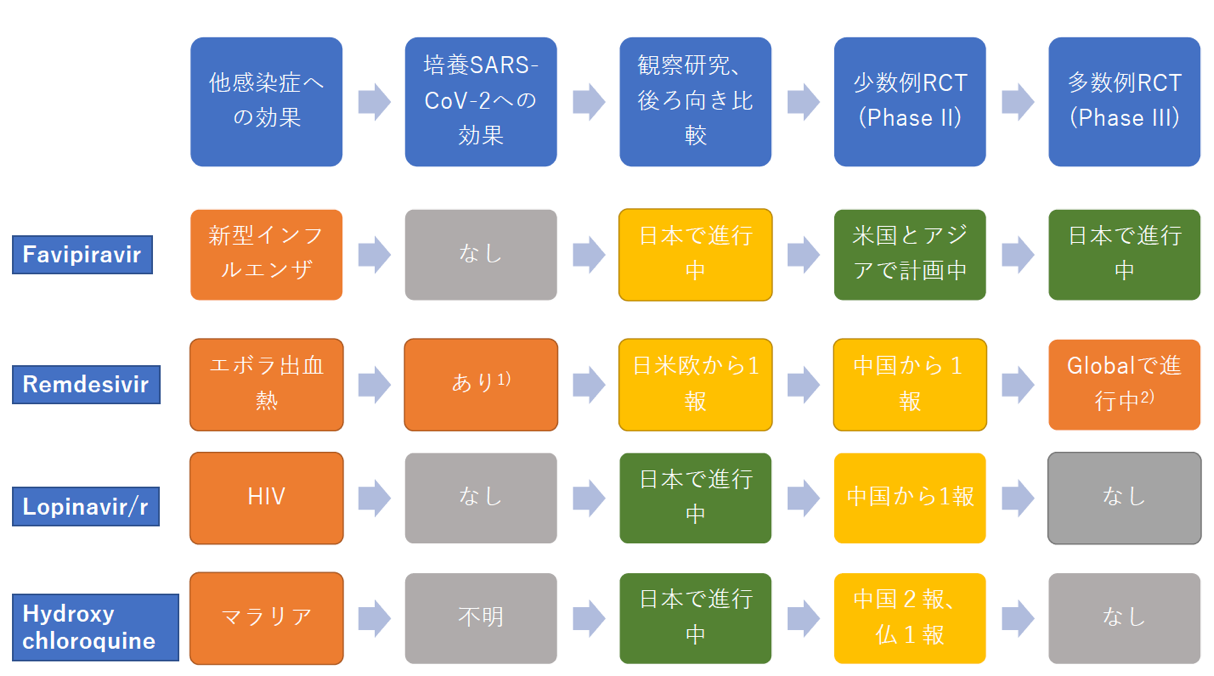 |
- 候補薬の対象ウィルスへの効果はまずin vitroで対象ウィルスを感染させた培養細胞(アフリカミドリサル腎臓上皮細胞由来のVero細胞など)に候補薬を投与して検討する。一般にin vitroで抗ウィルス効果のある薬剤のみが臨床試験に進む。In vitroで効果がなくても体内での化学的修飾や代謝中間体が抗ウィルス効果を示すことがあり得るが、今回検討されているような低分子化合物ではそのような可能性は非常に低いと思われる。
- Wang等はレムデシビル、ファビピラビル(アビガン),ロピナビル/リトナビル合剤(カレトラ) のSARS-Cov-2に対する抗ウイルス効果をVero細胞を用いたアッセイで評価した。SARS-CoV-2を感染させたVero細胞に各種候補薬剤を培養液中に投与してウィルス増殖抑制効果が見られたのはレムデシビルのみで、ファビピラビル, ロピナビル/リトナビル合剤には効果が見られなかった[12]。
- ヒドロキシクロロキンについては若干の増殖抑制効果がみられたものの、細胞毒性による見かけ上の効果の可能性が高い。同様の実験は国立国際医療研究センター研究所満屋研究室でも行われ、remdesivirのみに効果があるとの結果が得られている(未発表データ)。
- セリンプロテアーゼ阻害剤であるナファモスタットメシル酸塩(フサン) はSARS-Cov-2のSタンパク依存的膜融合を1-10nMの範囲で 阻害したとの報告があるが。尚、Vero細胞を用いた評価では抗ウイルス効果は確認されていない(満屋研究室のデータ)。
- 新規薬剤の場合は非臨床試験による動物実験での安全性チェックとPhase I-IIのヒトに投与した場合の安全性チェックと用量設定が必要であるが、既存薬ではヒトへの投与実績があるのでこのステップが省略される。
- 臨床研究ではRandomized Controlled Trial(RCT)による有効性の検証が行われる。エビデンスレベルの高い順に、多数例のRCT(Phase-III)、少数例のRCT (Phase-II)、単アームの観察研究やhistorical controlを対照とした後ろ向き比較研究がある。図に示すように、実際に行われる順番はこの逆であり、単アームの観察研究やhistorical controlを対照とした後ろ向き比較研究が各薬剤について内外で進行中である。この低いエビデンスレベルの試験で有望な薬剤であると判定されると次のRCTに進む。RCTの対照群としては通常は標準治療薬を投与した群が用いられるが、現時点でCOVID-19に対する標準治療薬が無いので抗ウィルス薬を投与しない保存的治療法群が対照群となる。少数例のRCT(phase-II)を経て多数例のRCT (phase-III)に進むことが一般的であるが、最初からPhase-III RCTを行ったりPhase II-IIIの形で行われることもある。いずれにしても何らかのRCTで有効性が証明された後に規制当局が承認し、保険収載へと進み、一般臨床での投与が可能となる。
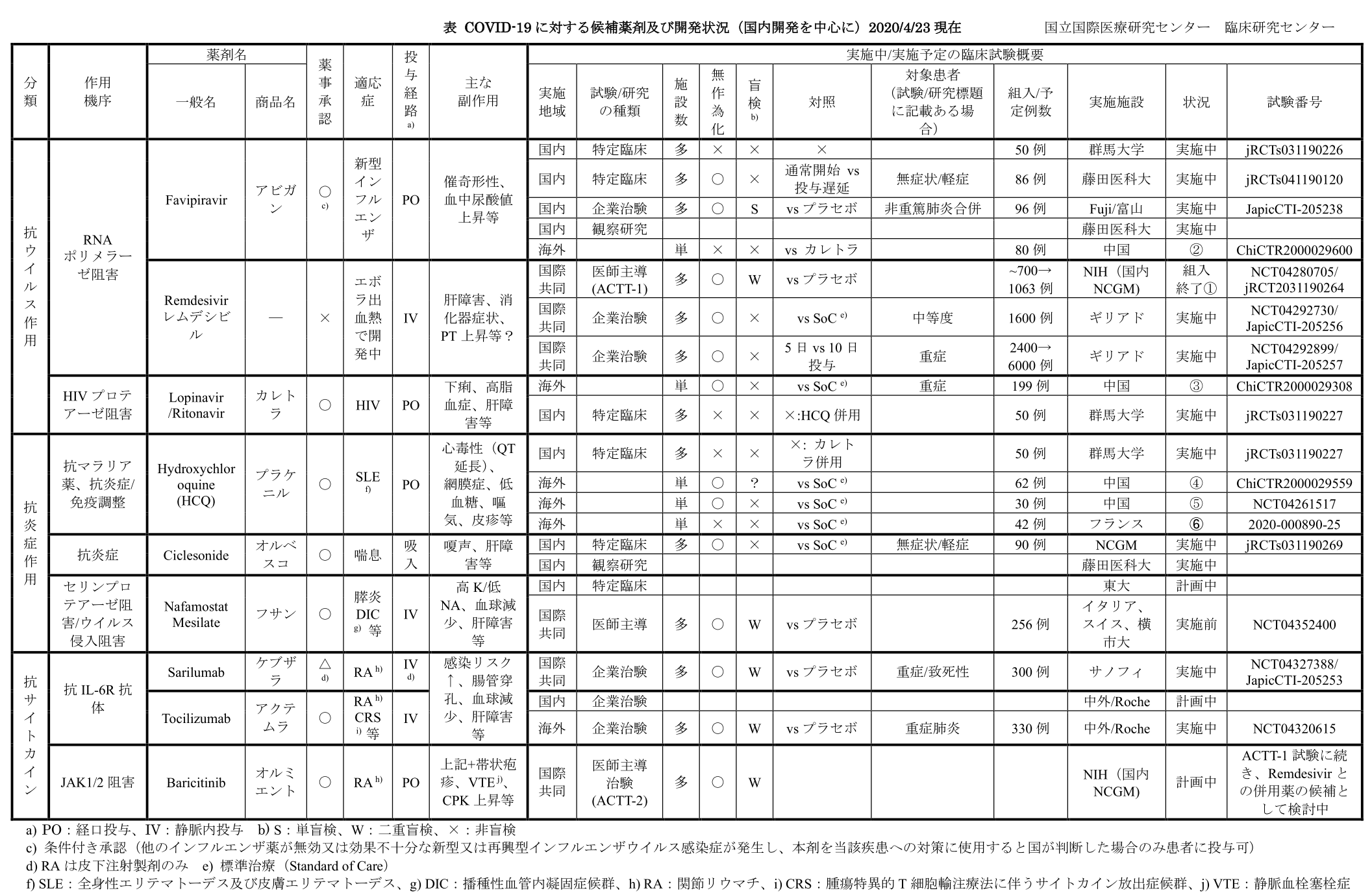
COVID-19に対する候補薬剤及び開発状況(国内開発を中心に)【表1】
作用機序別に国内外の候補薬剤の開発状況をまとめた。9種類の既存薬に対して22の試験が実施されている。うち実施中:14試験、終了:5試験、計画中:3試験となっている。二重盲検のデザインを取るものは5試験のみで、多くの試験で有効性を確信するにはエビデンスレベルの課題が残る。
| 表1 |
| COVID-19に対する候補薬剤及び開発状況(国内開発を中心に) |
| 作用機序別に国内外の候補薬剤の開発状況をまとめた。9種類の既存薬に対して22の試験が実施されている。 うち実施中:14試験、終了:5試験、計画中:3試験となっている。二重盲検のデザインを取るものは5試験のみで、多くの試験でevidence levelの課題が残る。 |
 |
COVID-19に対する臨床試験の文献紹介
COVID-19に対する治療薬について、新聞報道等での関心の高いものについて、発表された論文をもとに以下に解説する。(番号は表内の番号を示す)。ただし、現状、多くの既存薬がCOVID-19の治療薬候補として挙げられ、試験が進められているが、先にも書いたようにこれらの薬剤はSARS-CoV-2を狙って作られたものではないため、その有効性は限定的と考えるべきである。根本的な問題の解決はSARS-CoV-2特定的な治療薬の開発を期待するしかないと思われる。
レムデシビル
- 2020年4月29日、米国国立衛生研究所アレルギー・感染症研究所は同研究所が進めてきたレムデシビル国際共同試験(NCT04280705/ jRCT2031190264)の中間解析結果を発表した。それによるとレムデシビル投与群はプラセボ群に比して、31%回復日数が早かった(p<0.001)。回復に至る日数のメジアン値はレムデシビル投与群で11日、プラセボ群で15日であった。一方死亡率はレムデシビル投与群で8%、プラセボ群で11.6%とレムデシビル投与群少ない傾向が認められた(p=0.059)。COVID-19に対する有効性が実証されたのは、これは世界で最初であり、今後レムデシビルがCOVID-19の標準治療として位置づけられる可能性が高い[13]。
ファビピラビル(アビガン)
- ファビピラビル(アビガン)に関しては、国内外において複数の試験が実施されているが、現時点ではCOVID-19に対する有効性を示す論文は発表されていない。
- 中国の研究グループが「IFN-γ併用下でファビピラビルとロピナビル/リトナビル合剤の効果を比較し、ファビピラビルの有用性を示唆する論文」を発表したが、ランダム割付がなされておらず、群間の背景因子の差異(ファビピラビル群ではロピナビル/リトナビル合剤群に比べて、若年、低体重、発症から投与期間までの期間が短い等)が認められバイアスが除ききれないことから、論文が取り下げられた[14]。
ロピナビル/リトナビル合剤(カレトラ)
- ロピナビル/リトナビル合剤に関しては、現時点で有効性を示すデータはない。
- 実薬群(99例:ロピナビル400 mg/リトナビル100 mg 1日2回×14日間)における死亡率(19.2%)や集中治療室(ICU)での治療日数(6日)は、対照群(100例)でのデータ(死亡率:25.0%、ICU日数:11日)と比べ良好な傾向を認めるものの有意差は認められなかった (hazard ratio for clinical improvement, 1.24; 95% confidence interval, 0.90 to 1.72).。また、入院期間や咽頭ぬぐい液のウイルスRNA量の推移についても両群で差を認めなかった。一方、嘔気、嘔吐、下痢等の有害事象は実薬群で多い傾向を認めた[15]。
ヒドロキシクロロキン(プラケニル)
- トランプ米国大統領が言及したことから一躍注目を浴びているが、現時点では有効性が確認されていない。
- 対照群と比べ、HCQ(ヒドロキシクロロキン)群(200 mg 1日2回×5日間)投与群は、熱や咳嗽の改善が約1日早く、胸部CTで改善を認めた被験者の割合は、対照群(54.8%)と比べHCQ群(80.6%)で高い傾向を認めた[P=0.0476]。疾患の増悪を認めた被験者は、対照群13%に対し、HCQ群では認めなかった [16] 。
- 対照群(93.5%)とHCQ群(200 mg 1日2回×5日間;86.7%)との間で、主要評価項目である7日後の鼻咽頭検体のCOVID-19核酸陰性率は有意差を認めなかった[17] 。
- Gautelの研究では、計26例にHCQ(200 mg 1日3回×10日間)が投与され、うち6例(死亡:1例、ICUへの移動:3例、嘔気による薬剤中断:1例、退院希望:1例)は6日時の検体が採取できず解析から除外された。解析対象集団における6日時の鼻咽頭検体のCOVID-19核酸陰性率は、対照群(12.5%:2/16例)と比べて、HCQ群(70.0%:14/20例)群で高かった。また、HCQ投与例のうち、アジスロマイシンを併用した6例では6日時に全例陰性化が確認された [18] 。
- 一方、先のGautel等の発表に対する反証論文もでている。Molina等はGautel等と同容量でHCQとアジスロマイシンを11名の患者に投与。投与後5日以内に1名死亡、2名がICU、1名がQT延長*で投与中止となった。10名が鼻咽頭スワブのPCR検査を繰り返し行なったが、投与後5-6日の時点でも8/10症例が検査陽性であった。その結果、HCQの強い抗ウイルス効果と臨床上の有益性は無いと結論された[19] 。
- また、HCQとアジスロマイシン併用COVID-19患者におけるQT延長の報告が散見され、潜在的な心毒性が懸念されることから、NIHのCOVID-19治療ガイドラインでは、臨床試験以外でのHCQとアジスロマイシンの併用は推奨しないと記載されている(https://covid19treatmentguidelines.nih.gov/)。
国立国際医療研究センターでのCOVID-19治療薬開発の取り組み
本稿の最後に国立国際医療研究センターでの新薬開発の取り組みについて紹介したい。
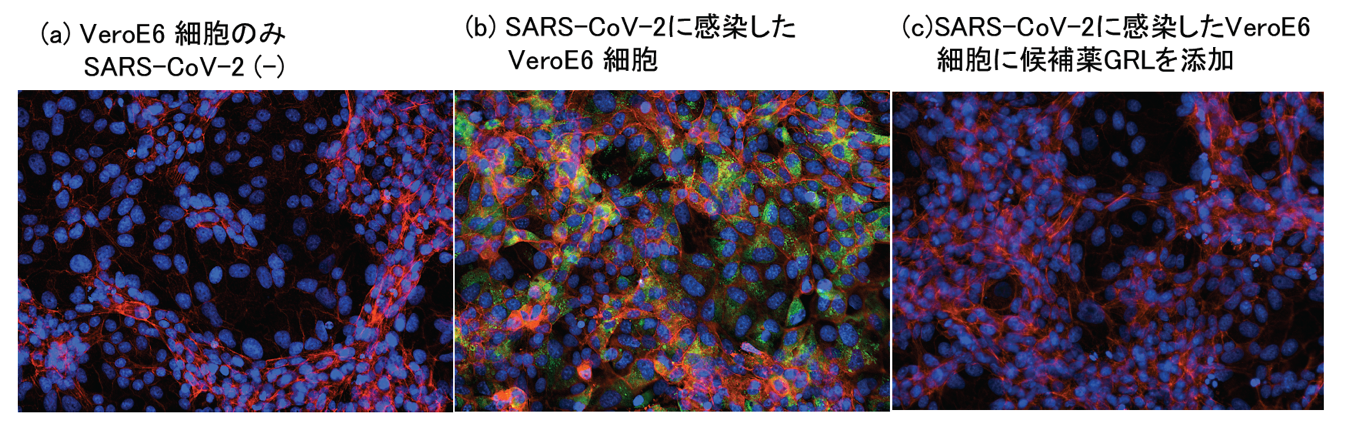
国⽴国際医療研究センター研究所の満屋裕明所長の研究室では米国Purdue大学及びNIH(⽶国⽴衛⽣研究所)とタッグを組んで、COVID-19の治療薬開発に取り組んでいる。COVID-19 の病原体、新型コロナウイルス・SARS-CoV-2 は、薬の開発において標的とすべきものがHIV の場合と似ている。SARS-CoV-2で狙う標的は3つある。1つ⽬はSARS-CoV-2 が細胞に侵入するステップ。2つ⽬はSARS-CoV-2 遺伝⼦複製を媒介するウイルス特有のRNA ポリメラーゼ。そして3つ⽬がSARS-CoV-2 の有するプロテアーゼ、特に主要な役割を果たすメインプロテアーゼを狙い撃ちする。このうち、すでに強⼒な抗SARS-CoV-2 効果を確認しているメインプロテーゼ阻害剤GRLのデータを示す【図2】。
| 図2 |
| COVID-19治療薬候補のGRL化合物はSARS-CoV-2の感染を完全に阻害した |
| メインプロテーゼ阻害剤GRLのSARS-CoV-2効果を蛍光顕微鏡で観察した(青:細胞核、赤:アクチン、緑:SARS-CoV-2抗原: 感染していれば緑が観察される)。 (c)はSARS-CoV-2を感染させたVeroE6細胞培地にGRL 1μMを添加した結果であるが、(b) GRLを添加していない像と比較すると感染細胞(緑)が全く観察されないこと、つまりSARS-CoV-2の感染が完全に抑えられたことがわかる。また、(c)では (a)同様に正常のVeroE6細胞像が観察される。 |
 |
[引用文献]
- 新型コロナウイルス感染症(COVID-19)WHO公式情報特設ページ(https://extranet.who.int/kobe_centre/ja/news/COVID19_specialpage)
- ProMED-mail, “Undiagnosed pneumonia – China (HU): RFI “Published, 2019-12-30 23:59:00 Archive Number: 20191230.6864153
- Lia van der Hoek et al., Identification of a new human coronavirus. Nature Medicine. 2004;10(4):368-373
- Patrick CY Woo, et al., Characterization and Complete Genome Sequence of a Novel Coronavirus, Coronavirus HKU1, from Patients with Pneumonia JVI. 2005;79(2):884–895
- Lee, N. et al. A major outbreak of severe acute respiratory syndrome in Hong Kong. N. Engl. J. Med. 2003; 348:1986–1994
- Zaki, A. et al., Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N. Engl. J. Med. 2012;367:1814–1820
- Suliman Khan et al., Emergence of a Novel Coronavirus, Severe Acute Respiratory Syndrome Coronavirus 2: Biology and Therapeutic Options. JCM. 2020; 58(5): e00187-20
- Roujian Lu et al., Genomic characterization and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020; 395: 565–74.
- G.J. Fraenkel et al., Penicillin at the Beginning. Annals of Diagnostic Pathology. 1998; 2(6): 422-424
- Mitsuya H, 3′-Azido-3′-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect of human T-lymphotropic virus type III/lymphadenopathy-associated virus in vitro. Proc Natl Acad Sci U S A. 1985; 82(20):7096-7100
- Manli Wang. et al., Cell Research. 2020; 30:269–271 “Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro”
- Yamamoto M., et al., bioRxiv 2020, 23 Aprildoi: https://doi.org/10.1101/2020.04.22.054981 “The anticoagulant nafamostat potently inhibits SARS-CoV-2 infection in vitro: an existing drug with multiple possible therapeutic effects.
- NIH clinical trial shows Remdesivir accelerates recovery from advanced COVID-19 (https://www.nih.gov/news-events/news-releases/nih-clinical-trial-shows-remdesivir-accelerates-recovery-advanced-covid-19)
- Qingxian Caia et al., Engineering 2020.“Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study” (https://www.sciencedirect.com/science/article/pii/S2095809920300631)
- Cao B et al. , March 18, “A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19 ( https://www.ncbi.nlm.nih.gov/pubmed/32187464) NEJM. DOI: 10.1056/NEJMoa2001282
- Zhaowei Chen, et al., medRxiv 2020 Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial(https://www.medrxiv.org/content/10.1101/2020.03.22.20040758v2)
- J Zhejiang Univ (Med Sci) 2020; 49 (1) (http://www.zjujournals.com/med/EN/10.3785/j.issn.1008-9292.2020.03.03)
- Gautret P. et al., Int J Antimicro Agents. 2020, (https://doi.org/10.1016/j.ijantimicag.2020.105949) Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial
- J.M. Molina et al., ScienceDirect 2020, 29 March No evidence of rapid antiviral clearance or clinical benefit with the combination of hydroxychloroquine andazithromycin in patients with severe COVID-19 infection.
