新型コロナウイルス感染症の血清疫学調査の調査結果とその解釈
| 新城 雄士 | 国立感染症研究所 感染病理部 非常勤研究員 |
| 鈴木 忠樹 | 国立感染症研究所 感染病理部 部長 |
| COI: | なし |
- 血清抗体検査は、急性感染症からの回復後であっても既感染者(過去に感染した人)として検出することができることから、集団内での感染症の発生状況を調査する疫学調査に適しており、本手法を用いた疫学調査を血清疫学調査という。
- 血清疫学調査は、ある特定の人口(国、都道府県、市町村、自治体など)における亜急性期・回復期の患者や既感染者を調べ調査集団内での感染症の発生状況を把握するために行う人口ベースの血清疫学調査と特定の集団(医療従事者やアウトブレイクの起きた集団など)における既感染者を調べて、特にリスク因子解析を行う特定の集団に対する血清疫学調査とに分類することができる。本稿で主に取り上げるのは、前者の「人口ベースの血清疫学調査」である。
- 多くの報告がある欧米の第1波後の血清疫学調査での抗体保有割合は、米国やスペイン、イギリス、スイスの一部では、抗体保有割合は5-20%であった。
- 日本で第1波後の6月初旬に行われた厚生労働省主導の血清疫学調査における抗体保有割合は、東京都で0.1%、大阪府で0.17%、宮城県で0.03%と低値であった。
- 新型コロナウイルス感染症における人口ベースの血清疫学調査では、検査方法の違い、血清有病率が結果に与える影響、標的ウイルス抗原により異なる抗体応答、抗体応答の不応者と誘導抗体の低下など、様々な注意点や制限を加味して、慎重に解釈すべきである。
- 抗体保有割合のみをもとに考えると、個々の感染だけで集団免疫を目指すのは困難である可能性が高い中で、安全性と有効性が科学的に担保されたワクチンや治療薬が広く実用化されることを期待しつつも、今後も感染の拡大の余地がある以上、社会・経済活動と両立を目指し、個々人および各組織の活動に適合したサステイナブルな感染防止策を模索し、かつ継続していくことが重要である。
血清疫学調査について
病原体感染により血清中に誘導された病原体に対する抗体の有無を検査する血清抗体検査は、感染早期の感染者を検出する目的には使用しにくいが、急性感染症からの回復後であっても既感染者(過去に感染した人)として検出することができる。このため集団内での累積の感染症の発生状況を調査する疫学調査に適する。本手法を用いた疫学調査を血清疫学調査という。
血清疫学調査は、ある特定の人口(国、都道府県、市町村、自治体など)における亜急性期・回復期の患者や既感染者を調べ調査集団内での感染症の発生状況を把握するために行う人口ベースの血清疫学調査と特定の集団(医療従事者やアウトブレイクの起きた集団など)における既感染者を調べて、特にリスク因子解析を行う特定の集団に対する血清疫学調査とに分類することができる。
本稿で主に取り上げるのは、前者の「人口ベースの血清疫学調査(population-based seroepidemiological investigation)」である。血清疫学調査では、感染してからある一定期間(通常発症から数週間以上)経過した人において、病原体に対する抗体が産生されていることを前提として、抗体保有(抗体陽性)割合を、既感染者(過去に感染した人)の割合の代替として調査する。
新型コロナウイルス感染症は、軽症例や無症候病原体保有者が一定数を占めるため、急性期の診断法であるPCRを使用して、すべての症例を把握するのは極めて困難である。そこで、経時的に人口ベースの血清疫学調査を実施することで、過去から直近までの流行の規模を、より正確に把握することが可能と考えられている。また、この情報により、サーベイランス感度(医師の届出等でどれだけの患者を把握できているか)を評価することやワクチン導入時の対象者数の算出などに使用するために重要な情報が得られることが期待できる[1]。
世界各地の新型コロナウイルス感染症の人口ベースの血清疫学調査(主に第1波前後)
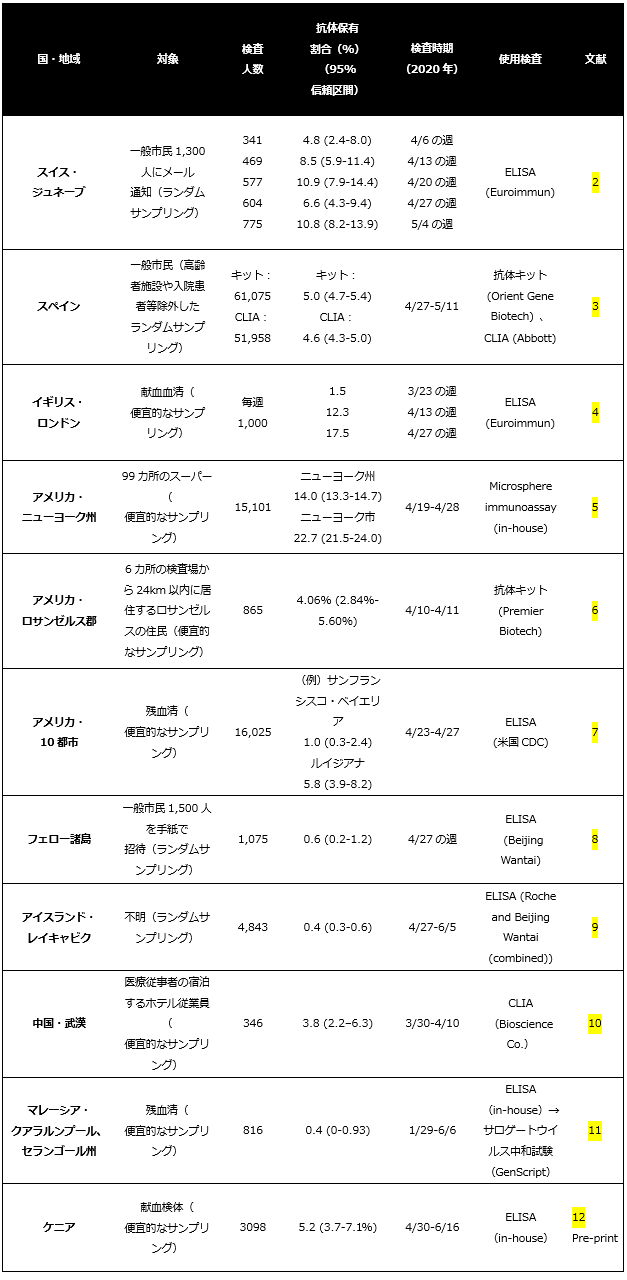
世界各地で人口ベースの血清疫学調査が行われているが、ここでは主に2020年3月~5月の流行を対象とした、検査対象の選定で明らかなバイアスがないと考えられる代表的な研究を取り上げる【図表1】。
| 図表1 |
| 世界各地の新型コロナウイルス感染症の人口ベースの血清疫学調査 |
 |
欧米
2020年3月~5月の流行で大きな被害を被った米国やスペイン、イギリス、スイスの一部では、抗体保有割合は5~20%となっている[2-7]。一方で、ヨーロッパにおいても地理的に独立したフェロー諸島やアイスランドでは、1%未満と非常に低い抗体保有割合となっている[8-9]。また、同一国内においても、人口密度等に大きな違いのある米国などでは、地域によって抗体保有割合に大きな開きがある[7]。
アジア
アジアでは、査読後論文として出版されている研究はまだ少ない。まず中国の武漢で346名のホテル従業員を対象として、CLIA(Bioscience Co.)を用いて3/30~4/10に行われた血清疫学調査では、抗体保有割合は3.8%(95% CI 2.2-6.3%)であった[10]。マレーシアのクアラルンプールとセランゴール州で、1/29~6/6に採取された816の残血清を対象として、ELISA(in-house)とサロゲートウイルス中和試験(GenScript)を組み合わせて行われた血清疫学調査では、抗体保有割合は0.4%(95% CI 0-0.93%)であった[11]。
その他の地域
欧米やアジア以外の血清疫学調査は執筆時点では、査読前の論文が大多数であり、解釈に注意が必要である。一例を紹介すると、ケニアで4/30~6/16に採取された3098の献血検体を対象として、ELISA(in-house)を用いて行われた血清疫学調査では、抗体保有割合は5.2%(95% CI 3.7-7.1%)であった[12]。また、日本や欧米とは異なり、第1波・第2波などの流行の波が明確ではない地域もあるため、流行のどのタイミングでの調査であるかを確認することが重要である。
日本の新型コロナウイルス感染症の血清疫学調査(第1波後)
わが国では、厚生労働省が主導で、2020年6月1日~6月7日にかけて、東京都・大阪府・宮城県において無作為抽出された一般住民(東京都1971名、大阪府2970名、宮城県3009名、計7950名)を対象に、抗体検査を実施された。検査には、アボット・ロシュから市販されている抗体検査がスクリーニングとして用いられ、両方で陽性となった検体が陽性と判定された。これをもとに算出すると、抗体保有割合は、東京都は2/1971(0.1%)、大阪府5/2970 (0.17%)、宮城県1/3009(0.03%)であった[13]。また、国立感染症研究所で中和試験による機能的抗体保有割合の評価も行われ、上記2種の抗体検査の両方で陽性となった検体は中和試験でも陽性であった[14]。一方で片方のみで陽性であった検体や陽性判定の閾値付近の検体についても中和試験が行われたが、すべて陰性であった。
新型コロナウイルス感染症において、人口ベースの血清疫学調査を解釈する際の注意点・制限
上記の通り、新型コロナウイルス感染症において、血清疫学調査の研究結果が日々報告されている。特に人口ベースのものを解釈する際には、以下の点に留意して、それぞれの調査結果を正しく解釈する必要がある。
1.検査方法の違い
血清疫学調査では、多くの検体検査を短期間で行う必要があるため、スループット性も重視する一方で、検査精度が重要となる。主に用いられる検査法としては、
- イムノクロマト法(いわゆる「抗体キット」を用いた検査法)
- ELISA(enzyme-linked immunosorbent assay)
- CLIA(化学発光酵素免疫測定法;chemiluminescent immunoassay)
- 中和試験
などがある。使用目的や(亜急性期・回復期の患者や既感染者等を含めた)予想される集団の血清有病率(seroprevalenceの日本語訳として、血清有病割合が正しいと考えられるが、本稿では、日本疫学会などに合わせて、血清有病率と記載する)に応じて、それぞれの特徴を踏まえて使用することが重要である[15]。
抗体キットは簡便で迅速に結果が判明するが、感度・特異度ともに他の方法と比較して劣り、製品ごとのばらつきも大きい。ELISAは、市販のものから各研究室で自家製(in-house)のものまで様々であり、どの抗原を使用するかなどで感度・特異度が大きく変わってくる。CLIAは、市販のものが主であり、スループット性が高く、感度・特異度も製品によるが、一般に高い。使用する機器のメンテナンスコストや価格が高くなりうるのがネックとなる。
中和試験は、生きたウイルスを使用するため、日本国内ではバイオセーフティレベル3の施設が必要となり、実施可能な施設が非常に限られるが、特異度が高く、唯一、抗体の機能的な評価が可能となる。また、バイオセーフティレベル2の施設で中和試験が実施できるようにレンチウイルスや水疱口炎ウイルスをベースにしたシュードタイプウイルスを用いた中和試験(他のウイルスの表面に新型コロナウイルスの蛋白を発現させてこの新型コロナウイルスの蛋白に結合する抗体を検出する方法)が数多く報告されている。シュードタイプウイルスを用いた中和試験はスループット性と感度が高いが、シュードタイプウイルスで評価された抗体の機能は本物の新型コロナウイルスに対する抗体の機能と完全に一致する保証はないことに注意が必要である。一般的に中和機能の正確な評価が求められる場合は、シュードタイプウイルスでの評価に加えて本物のウイルス(この場合、新型コロナウイルス)での評価が求められることが多い。
このように抗体検査には様々な方法が存在しており、それぞれの検査系について性能が報告されているが、その評価には同一の検査においても大きなばらつきがある。その大きな理由としては、それぞれの検査自体の性能の問題だけでなく、多くの場合、検証方法そのものにも問題があることである。新型コロナウイルス感染症では重症度に応じて抗体誘導が異なることが分かってきており、検査感度の正確な評価には無症候感染から致死的感染まで重症度スペクトラムの全てを網羅する検体パネルを用いて検証試験を実施する必要がある。
しかしながら、検証試験の多くは検体の入手が容易な入院患者検体(つまり、重症患者)を用いて実施され、無症候者や軽症例の検体を用いた検証はほとんど実施されていない。多くの抗体検査では、無症候感染者を含め新型コロナウイルス感染者の全体を捉えるための検査としての感度が明らかになっていないことは、既感染者の全てを捉える必要がある血清疫学調査において大きな問題となる。血清疫学調査の結果を正しく解釈するためには、調査で使用された検査法の感度がどのような方法で検証されているのかを把握し、調査で捉えた集団がどのような集団であるかと考察する必要がある。
一方、特異度については、新型コロナウイルス以外の病原体、特に季節性コロナウイルス(いわゆる、かぜウイルスの一種)への感染により産生された抗体との交叉性の問題がある。この点については、標的抗原の作製方法を工夫することにより、これらのウイルスに対する交叉性を低減させることが可能であり、多くの検査法でそのような対応がなされているが、それ以外にもそれぞれの検査特有の試薬などによる非特異反応が原因となり特異度が低下することもある。以上のような理由から、現在までに血清疫学調査に最適の抗体検査法として定まった方法はなく、血清疫学調査の結果を解釈する際には調査に使用した検査法の特性を踏まえた考察が重要となる。
2.血清有病率により変わる結果の解釈
(特に日本の調査のように血清有病率が低い場合)
血清有病率(seroprevalenceの日本語訳として、血清有病割合が正しいと考えられるが、本稿では、日本疫学会などに合わせて、血清有病率と記載する)が極端に低い場合は、その解釈に特に注意が必要となる[16]。例えば、感度98%、特異度98%の検査であったとしても、血清有病率が0.1%であれば、主に特異度に影響されて、陽性的中率(検査が陽性のときに実際に感染している可能性)は4.7%と非常に低値となる。こうした場合は、日本の調査で行われていたとおり、複数の種類の検査を組み合わせることで、より結果の信頼性を高めることができる。初回に使用するべき検査法は、感度の高い方法で、偽陽性を許容しつつ、より多くの陽性検体を拾い上げ(いわゆるスクリーニング目的として)、2回目の検査はより特異度の高い検査法を使用して、偽陽性を除外するなどの検査戦略が検討される。
また、新型コロナウイルスは少数の感染者が大多数の2次感染例を起こす[17]ことからも想定されるように、クラスターやスーパースプレッディングイベントを起こすことが知られており、既感染者の分布に濃淡のある可能性が高い。このような新型コロナウイルスの特徴的な感染伝播様式は、ランダムサンプリング、サンプルサイズの適切な設定に影響を与えると考えられる。
特に、血清有病率が低い場合は、このような影響が大きくなることに注意する必要がある。調査に適切なサンプルサイズについても、信頼区間を十分に狭くするために、よく検討することが必要である。WHOによる人口ベースの血清疫学調査のプロトコル[18]では、OpenEpi(http://www.openepi.com/Menu/OE_Menu.htm)などを利用したサンプルサイズ計算が言及されている。一般的に血清有病率が低いほど、大きなサンプルサイズが必要となる。サンプルサイズが大きくなれば調査にかかるコストや手間が増加することから、いつでも大規模な調査が可能なわけではないが、予測される血清有病率に比し、十分なサンプルサイズを用意することが難しい場合は、得られた結果の解釈には注意が必要である。
3.標的ウイルス抗原により異なる抗体応答
市販の抗体検査を含め、新型コロナウイルスに対する抗体検査では、主にヌクレオカプシドタンパク質(N抗原)に対する抗体を測定するものとスパイクタンパク質(S 抗原)に対する抗体を測定するもの、またこれらの一部(レセプター結合部位など)やこれらのうちの複数を測定するものがある。査読前論文からの報告で、さらなる知見の蓄積が必要であるものの、N抗原に対する抗体価はS抗原に対する抗体価よりも低下が早い可能性が指摘されている[19]。また、N抗原は新型コロナウイルスと季節性コロナウイルスとの間で相同性が高いため、交叉性のある抗体が季節性コロナウイルス感染によって産生され、新型コロナウイルスの感染履歴がないにも関わらず抗体陽性と判定される可能性がある。N抗原を標的とする多くの市販検査では、季節性コロナウイルスのN抗原に対する抗体の交差反応を低減する努力がなされているが、その詳細については開示されてなく、どのような科学的根拠に基づいて特異的な抗体を検出しているのか詳細不明であることが多い。
一方、ウイルスにより多様性に富むスパイクを標的とした抗体検査は特異性が高く、中和抗体との相関性が高いことが知られており、秋冬に季節性コロナウイルスが増えると考えられる中で、新型コロナウイルスに対する特異性という観点でスパイクに対する抗体の検査が好ましいという意見もある。ただし、スパイクの一部であるレセプター結合部位の特異性は高いものの、スパイクの分子内にも季節性コロナウイルスとの共通性が高い部位があるので、それぞれの検査において、どのような設計の標的抗原を使用しているのかを把握することが、正しい結果の解釈には重要となる。いずれにしても、どのような標的抗原を用いた検査においても、長期間の追跡調査が不十分な現状で十分な議論を経ずに結論を出すことは時期尚早であり、今後、さらなる知見の集積が求められている。
4.抗体応答の不応者と誘導抗体の低下
新型コロナウイルス感染症において、抗体価が経時的に減少するという研究結果の報告が、特に軽症例や無症候例からの回復期においていくつかあるが[20-22]、病原体への初感染において、経時的に抗体価が低下してくることは免疫学的には当然の現象であり、新型コロナウイルス感染症に特異的な現象ではない。ただ、この抗体価の低下は、それぞれの検査特性によるものの可能性(例えば抗体の認識する抗原の種類など)や、抗体自体は低程度に産生があるものの、検査の検出感度未満となっている可能性があるため、すべての抗原に対する抗体が低下するかはさらなる知見の集積が必要である。抗体価が低下することの血清疫学調査の解釈における影響としては、ある一定数の人口では、抗体価が数ヶ月で検出感度未満になってしまい、数ヶ月以上前の感染については、検知できなくなる可能性があることである。新型コロナウイルス感染症が流行してから半年以上が経過した今後、この影響はより大きくなる。
新型コロナウイルス感染に対応する免疫としては、液性免疫だけでなく細胞性免疫も重要な役割を果たしていることが明らかになってきており、一部の感染者では細胞性免疫のみで液性免疫応答が低いことが指摘されている[23-25]。このような感染者や抗体が陰性化した感染者については、T細胞やB細胞のような免疫細胞を解析することにより、新型コロナウイルス感染に対する免疫応答、すなわち感染履歴を検出することが可能である[26]。
しかしながら、このような検査には血清や血漿だけでなく活きた血球が必要になり、コスト面や検体採取工程の煩雑さから、血清疫学調査のような大規模な調査を実施するには大変な困難が伴い、現時点では、既感染者を拾い上げる方法として実用的ではない。結核で使用されるELISPOTと同様のT細胞性免疫を測定する検査系も開発され、市販されている検査系もあるが[27]、季節性コロナウイルス感染との交叉反応が多く、新型コロナウイルス感染者を検出する方法として使用することは難しい。液性免疫応答が低い、もしくは抗体が検出限界以下まで低下した感染者は、原理的に現在の血清疫学調査で検知することは不可能であり、感染者の全体像を捉えるためには、血清疫学調査だけでなく、液性免疫応答の乏しい個体が感染者のどのくらいいるのかを把握するための調査など、様々な調査研究を組み合わせて評価する必要がある。
また、抗体の低下に関連して議論されることとして、新型コロナウイルスの再感染もしくは再燃を疑う報告がメディア等で散見される。この両者は、臨床的に区別することは非常に難しいが、それぞれにおけるウイルス感染動態は全く異なる。再感染とは、一度ウイルスに感染し排除された既感染者が後に新たにウイルスに感染する現象であり、再燃とは、ウイルスに感染し発症した患者が回復後も体内に少量のウイルスが存在し続けた後、再度ウイルスが増殖したものである。新型コロナウイルス感染症では多くの呼吸器ウイルス感染症よりも回復まで時間がかかることが多く、またウイルスが検出される期間も長いことから、PCR検査陰性となっても2~3ヶ月以内は検出限界以下の微量のウイルスが体内に残存し続け、PCR検査再陽性となることがあるが、再陽性時には感染性ウイルスは存在せず、特段の臨床対応は必要ないと報告されている[28]。
このような再陽性症例は、再燃や再感染とは全く異なるものであり、真の意味で再燃と再感染の頻度やその病態については、多くの疑問が残されている。再感染に関しては、これまでに査読済み論文としては1例のみ報告されているが[29]、この症例では、2回目の感染は検疫で見つかった無症候性であった。1回目の感染と2回目の感染からのウイルスゲノム解析で、24箇所で塩基配列が異なることがわかり、初感染とは異なるウイルスへの再感染が示唆された。1回目の感染直後の抗体の有無は不明であったが、2回目の感染が判明した翌日(無症候性であり発症からの日数は不明)のIgG(アボットのCLIAを使用)は陰性であった。しかし、5日後には、IgGが陽転化した。本報告のような再感染がどれほどの頻度で起こるかは不明であり、今後類似の報告の集積が待たれる。一方、再燃に関しては、ゲノム配列に大きな違いのない生きたウイルスが1回目と再燃時に分離されるなどの証拠が必要となる。
5.抗体の有無が意味すること
これまでに述べてきた事項と関連する総括的な意味合いが強いが、「抗体が存在する」ということは、検査前確率や各検査の感度・特異度を踏まえた上での議論になるものの、「過去に感染した可能性が高い」ということを意味するのみで、それ以上でもそれ以下でもない。また、「中和抗体が存在する」ということは、少なくともin vitroの実験下では、機能的に細胞をウイルス感染から防御する能力があるということであり、感染防御に寄与する可能性のある免疫を持つという意味づけをできるかもしれない。ただし、現時点で、新型コロナウイルス感染症の感染予防、発症予防、重症化予防との相関が証明された免疫学的な指標は全く存在せず、中和抗体を含む抗体の感染予防、発症予防、重症化予防における意義も不明である。
現在、急ピッチで進められているワクチン開発においても中和抗体を含む抗体が重要な免疫の代替指標とされているが、インフルエンザなど他の呼吸器ウイルス感染症での知見やヒトの免疫を再現性高く定量的に評価する方法が限られていることなどから、暫定的に抗体を免疫応答の指標としている状況であり、「抗体の存在」が感染防御の「免疫パスポート」として使用できるかどうかは、現時点では全く不明である。今後、ワクチンの臨床試験第三相の結果が公表される中で、発症率や重症化率、死亡率と抗体の有無や抗体価との相関性を評価することにより、「抗体の存在意義」について知見が集積されてくることが期待されるが、感染防御における抗体を含む免疫の意義を正しく理解するためには、数度のワクチンの臨床試験のみでは全く不十分であり、実際の感染流行の中で疫学、臨床、ウイルス学、免疫学など様々な観点から今後、数年~十数年にわたり1つ1つエビデンスを積み上げていく必要があり、本研究領域に関わる全ての研究者の継続的な努力が求められる。
まとめ
本稿では、主に人口ベースの血清疫学調査についての概要と世界やわが国で実施されて公開されている主な調査結果を紹介し、これら調査結果を解釈する上での注意点や制限について述べた。2020年3月~5月の流行後の血清疫学調査では、米国やイタリアなどの第1波の流行の際に医療崩壊が起きた地域においても、抗体保有割合は20%程度であり、現在でも免疫学的にナイーブな集団が大多数である。また、どの程度一般的であるかは不明であるが、再感染を疑う事例の報告もみられるようになってきた。
日本では、第1波後の血清疫学調査で、患者が多く発生した東京でさえも、抗体保有割合が0.1%と低値であることが判明した。個々の感染だけで集団免疫を目指すのは困難である可能性が高い中で、ワクチンの実用化が待たれる。しかし、ワクチンについては、政治利用の対象となりうることは、科学界からも指摘されており[30]、開発が先行している核酸ワクチンやウイルスベクターワクチンなど、既存のプラットフォーム(不活化ワクチンや生ワクチンなど)とは異なる全く新しいワクチンでは尚更の注意が必要であり、しっかりと安全性と有効性を担保した上で、広く実用化されることが望ましいことは言うまでもない。
ワクチンに限らず、米国では食品医薬品局(food and drug administration; FDA)により有効性が十分に実証されていないヒドロキシクロロキンや回復者血漿の緊急使用許可(emergency use authorization; EUA)が出されており、今後、さらに同様の判断がなされる可能性も否定できない[31]。EUAは承認(approval)とは別物ではあるものの、医療現場も含め一般にはその違いが十分に認識されておらず、政治家の実績作りに利用されているのではないかという疑義が持たれている。特に米国においては、11月に大統領選を控えて、現職大統領が自身の実績作りのために、10月までに不十分なエビデンスを基に開発中のワクチンを承認する可能性も取りざたされている。科学と政治は感染症対策の両輪ではあるが、目指すべきは科学的証拠に基づいた政治的判断であり、為政者の恣意的な科学の政治利用は、政府への信用を失い、感染症対策の破綻を招くことになりかねない。このような事態は、日本にとっても決して対岸の火事ではない。
我々科学者には、引き続き、限られたエビデンスを最大限に活用し、政府やその他ステークホルダーへ科学的側面から適切に助言していくことが求められている。今後、有効な治療薬やワクチンが開発されたとしても、それらが100%有効な”magic bullet”であることを安易に期待することはできない。今後も感染の拡大の余地がある以上、社会・経済活動と両立を目指し、個々人および各組織の活動に適合したサステイナブルな感染防止策を模索し、かつ継続していくことこそが重要である。
[引用文献]
- Centers for Disease Control and Prevention. COVID-19 Serology Surveillance Strategy. 2020 [updated 25 June 2020]. Available from: https://www.cdc.gov/coronavirus/2019-ncov/covid-data/serology-surveillance/index.html
- Stringhini S, Wisniak A, Piumatti G, et al. Seroprevalence of anti-SARS-CoV-2 IgG antibodies in Geneva, Switzerland (SEROCoV-POP): a population-based study. Lancet. 2020;396(10247):313-9. doi:10.1016/S0140-6736(20)31304-0
- Pollán M, Pérez-Gómez B, Pastor-Barriuso R, et al. Prevalence of SARS-CoV-2 in Spain (ENE-COVID): a nationwide, population-based seroepidemiological study. Lancet. 2020;396(10250):535-44. doi:10.1016/S0140-6736(20)31483-5
- Public Health England. Sero-surveillance of COVID-19. 2020 [updated 28 Aug 2020]. Available from: https://www.gov.uk/government/publications/national-covid-19-surveillance-reports/sero-surveillance-of-covid-19
- Rosenberg ES, Tesoriero JM, Rosenthal EM, et al. Cumulative incidence and diagnosis of SARS-CoV-2 infection in New York. Ann Epidemiol. 2020;48:23-9.e4. doi:10.1016/j.annepidem.2020.06.004
- Sood N, Simon P, Ebner P, et al. Seroprevalence of SARS-CoV-2-Specific Antibodies Among Adults in Los Angeles County, California, on April 10-11, 2020. JAMA. 2020;323(23):2425-7. doi:10.1001/jama.2020.8279
- Havers FP, Reed C, Lim T, et al. Seroprevalence of antibodies to SARS-CoV-2 in 10 sites in the United States, March 23-May 12, 2020. JAMA Intern Med. 2020;10.1001/jamainternmed.2020.4130. doi:10.1001/jamainternmed.2020.4130
- Petersen MS, Strøm M, Christiansen DH, et al. Seroprevalence of SARS-CoV-2-specific antibodies, Faroe Islands. Emerg Infect Dis. 2020;26(11):10.3201/eid2611.202736. doi:10.3201/eid2611.202736
- Gudbjartsson DF, Norddahl GL, Melsted P, et al. Humoral immune response to SARS-CoV-2 in Iceland. N Engl J Med. 2020;10.1056/NEJMoa2026116. doi:10.1056/NEJMoa2026116
- Xu X, Sun J, Nie S, et al. Seroprevalence of immunoglobulin M and G antibodies against SARS-CoV-2 in China. Nat Med. 2020;26(8):1193-5. doi:10.1038/s41591-020-0949-6
- Sam IC, Chong YM, Tan CW, Chan YF. Low postpandemic wave SARS-CoV-2 seroprevalence in Kuala Lumpur and Selangor, Malaysia. J Med Virol. 2020;10.1002/jmv.26426. doi:10.1002/jmv.26426
- Uyoga S, Adetifa IM, Karanja HK, et al. Seroprevalence of anti-SARS-CoV-2 IgG antibodies in Kenyan blood donors. medRxiv. 2020;10.1101/2020.07.27.20162693. doi: 10.1101/2020.07.27.20162693
- 厚生労働省.抗体保有調査結果.2020年6月16日掲載.https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00132.html
- 厚生労働省.抗体保有調査における中和試験の結果について.2020年7月14日掲載.https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00132.html
- Lisboa Bastos M, Tavaziva G, Abidi SK, et al. Diagnostic accuracy of serological tests for covid-19: systematic review and meta-analysis. BMJ. 2020;370:m2516. doi:10.1136/bmj.m2516
- Caini S, Bellerba F, Corso F, et al. Meta-analysis of diagnostic performance of serological tests for SARS-CoV-2 antibodies up to 25 April 2020 and public health implications. Eurosurveillance. 2020;25(23):2000980. doi:10.2807/1560-7917.ES.2020.25.23.2000980
- Bi Q, Wu Y, Mei S, et al. Epidemiology and transmission of COVID-19 in 391 cases and 1286 of their close contacts in Shenzhen, China: a retrospective cohort study. Lancet Infect Dis. 2020;20(8):911-9. doi:10.1016/S1473-3099(20)30287-5
- World Health Organization. Population-based age-stratified seroepidemiological investigation protocol for coronavirus 2019 (COVID-19) infection. 2020 [updated 26 May 2020]. Available from: https://www.who.int/publications/i/item/WHO-2019-nCoV-Seroepidemiology-2020.2
- Grandjean L, Saso A, Ortiz A, et al. Humoral response dynamics following infection with SARS-CoV-2. medRxiv. 2020;10.1101/2020.07.16.20155663. doi: 10.1101/2020.07.16.20155663
- Ibarrondo FJ, Fulcher JA, Goodman-Meza D, et al. Rapid decay of anti-SARS-CoV-2 antibodies in persons with mild Covid-19. N Engl J Med. 2020;NEJMc2025179. doi:10.1056/NEJMc2025179
- Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020;26(8):1200-4. doi: 10.1038/s41591-020-0965-6
- Seow J, Graham C, Merrick B, et al. Longitudinal evaluation and decline of antibody responses in SARS-CoV-2 infection. medRxiv. 2020;10.1101/2020.07.09.20148429. https://doi.org/10.1101/2020.07.09.20148429
- Le Bert N, Tan AT, Kunasegaran K, et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature. 2020;584(7821):457-62. doi: 10.1038/s41586-020-2550-z
- Grifoni A, Weiskopf D, Ramirez SI, et al. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals. Cell. 2020;181(7):1489-501. doi:10.1016/j.cell.2020.05.015
- Sekine T, Perez-Potti A, Rivera-Ballesteros O, et al. Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. Cell. 2020. doi: 10.1016/j.cell.2020.08.017
- Cox RJ, Brokstad KA. Not just antibodies: B cells and T cells mediate immunity to COVID-19. Nat Rev Immunol. 2020;1-2. doi:10.1038/s41577-020-00436-4
- ヒトIFN-γ/IL-2 SARS-CoV-2 ELISpot・FluoroSpotキット. コスモバイオ株式会社. https://www.cosmobio.co.jp/product/detail/ifn-gamma-il2-sars-cov2-elispot-fluorospot-human-mab.asp?entry_id=36993
- Korean Centers for Disease Control & Prevention. Findings from investigation and analysis of re-positive cases. 2020 [updated 19 May 2020]. Available from: https://www.cdc.go.kr/board/board.es?mid=a30402000000&bid=0030
- To KK, Hung IF, Ip JD, et al. COVID-19 re-infection by a phylogenetically distinct SARS-coronavirus-2 strain confirmed by whole genome sequencing. Clin Infect Dis. 2020;ciaa1275. doi:10.1093/cid/ciaa1275
- Thorp HH. A dangerous rush for vaccines. Science. 2020;369(6506):885. doi:10.1126/science.abe3147
- Avorn J, Kesselheim A. Regulatory Decision-making on COVID-19 Vaccines During a Public Health Emergency. JAMA. 2020;10.1001/jama.2020.17101. doi:10.1001/jama.2020.17101
